
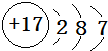
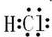 ;
;分析 短周期的三种元素X、Y、Z,原子序数依次减小,X元素原子核内无中子,则X为H元素;Y元素原子的最外层电子数是其电子层数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;X、Y、Z元素原子的核外电子层数之和是6,则Z的电子层数为6-1-2=3,Z元素原子最外层电子数为7,故Z为Cl元素.
解答 解:短周期的三种元素X、Y、Z,原子序数依次减小,X元素原子核内无中子,则X为H元素;Y元素原子的最外层电子数是其电子层数的2倍,最外层电子数不超过8,原子只能有2个电子层,最外层电子数为4,故Y为C元素;X、Y、Z元素原子的核外电子层数之和是6,则Z的电子层数为6-1-2=3,Z元素原子最外层电子数为7,故Z为Cl元素.
(1)Y为C元素,元素在周期表中第二周期IVA族;Z为Cl元素,原子结构示意图是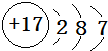 ,
,
故答案为:第二;IVA;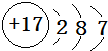 ;
;
(2)仅由H元素与C元素形成的化合物称为烃,化合物HCl的电子式是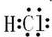 ,
,
故答案为:烃;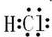 ;
;
(3)氯气与NaOH溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(4)氯气与大气污染物(SO2)在水溶液中反应的化学方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:Cl2+SO2+2H2O=2HCl+H2SO4.
点评 本题考查结构性质位置关系,推断元素是解题的关键,侧重对化学用语与元素化合物性质的考查,注意对基础知识的理解掌握.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:选择题
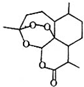 屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )
屠呦呦1971年发现、分离、提纯并用于治疟新药“青蒿素”,拯救了数千万人的生命.青蒿素分子结构如图.下列说法错误的是( )| A. | 青蒿素的分子式为C15H22O5 | B. | 青蒿素是芳香族化合物 | ||
| C. | 青蒿素可以发生水解反应 | D. | 青蒿素不能使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在共价化合物中一定含有共价键 | |
| B. | 含有离子键的化合物一定就是离子化合物 | |
| C. | 双原子单质分子中的共价键一定是非极性键 | |
| D. | 原子最外层电子数大于4的元素一定是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫是黄色能溶于水的晶体 | |
| B. | 臭氧空洞的形成主要与SO2有关 | |
| C. | 硫在自然界仅以化合态存在 | |
| D. | 硫既能与某些金属反应又能与某些非金属反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验方案 | 实验现象 |
| ① | 向盛有少量溴化钠溶液的试管中滴加少量新制氯水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈橙红色 |
| ② | 向盛有少量碘化钠溶液的试管中滴加少量新制溴水,振荡,再加入少量四氯化碳,振荡后静置 | 液体分为两层,下层 呈紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
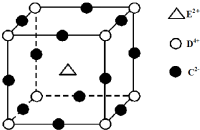 周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.
周期表中前四周期元素A、B、C、D、E的原子序数依次增大.元素A的单质有多种同素异形体,其中一种是天然存在的最坚硬的固体;元素C的原子最外层电子数是其内层的3倍;基态D原子的价电子排布为(n+1)dn(n+2)sn;基态E2+的3d轨道中有5个电子.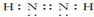 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com