
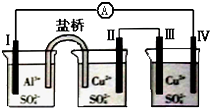
| A. | 电极Ⅱ逐渐溶解 | B. | 电极Ⅰ发生氧化反应 | ||
| C. | 电流方向:电极Ⅰ→A→电极Ⅳ | D. | 电极Ⅲ的电极反应:Cu2++2e-=Cu |
分析 电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,电流方向从正极流向负极,负极上失电子发生氧化反应,正极上得电子发生还原反应,据此分析解答.
解答 解:电极Ⅰ为Al,其它均为Cu,Al易失电子作负极,所以Ⅰ是负极、Ⅳ是阴极,Ⅲ是阳极、Ⅱ是正极,
A.电极Ⅱ是正极,正极上发生反应为Cu 2++2e-=Cu,所以电极Ⅱ质量逐渐增大,故A错误;
B.电极Ⅰ上电极反应式为Al-3e-=Al3+,发生氧化反应,故B正确;
C.电流从正极沿导线流向负极,即电极Ⅳ→A→电极Ⅰ,故C错误;
D.电极Ⅲ为阳极,电极反应式为Cu-2e-═Cu 2+,故D错误;
故选B.
点评 本题考查了原电池原理,正确判断正负极是解本题关键,再结合各个电极上发生的反应来分析解答,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷(乙炔):通过盛溴水的洗气瓶 | |
| B. | 乙酸乙酯(乙醇):加入乙酸和浓硫酸的混合液,然后加热 | |
| C. | 苯(苯酚):加入氢氧化钠溶液,然后分液 | |
| D. | 乙醇(水):加入生石灰,然后蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同体积、相同pH的三种溶液:①CH3COOH、②HCl、③H2SO4,中和NaOH的物质的量由大到小的顺序是:①>③>② | |
| B. | NaHCO3溶液中有:c(Na+)+c(H+)═c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 相同浓度的下列溶液:①CH3COONH4、②CH3COONa、③CH3COOH中,c(CH3COO-)由大到小的顺序是:②>①>③ | |
| D. | pH=4的Al2(SO4)3溶液中,水电离出H+的物质的量浓度为10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NaHSO4 和 Ba(OH)2 | B. | MgCl2和 NH3•H2O | C. | NaAlO2 和 H2SO4 | D. | AlCl3 和 NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
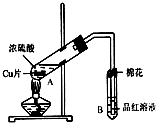 某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.
某研究小组用如图所示装置进行铜与浓硫酸反应的实验研究.| 坩埚质量 | 坩埚与晶体的总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.9g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 次氯酸钠溶液与醋酸溶液混合:ClO-+H+═HClO | |
| C. | Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| D. | 浓硝酸中加入过量铁粉并加热:Fe+3NO3-+6H+ $\frac{\underline{\;\;△\;\;}}{\;}$ Fe3++3NO2↑+3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com