
【题目】将一定量的氯气通入50mL浓度为![]() 的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、
的氢氧化钠浓溶液中,加热少许时间后溶液中形成NaCl、NaClO、![]() 共存体系。下列判断正确的是
共存体系。下列判断正确的是
A.与NaOH反应的氯气一定为![]() mol
mol
B.![]() :
:![]() 可能为7:3
可能为7:3
C.若反应中转移的电子为n mol,则![]()
D.![]() :
:![]() :
:![]() 可能为11:1:2
可能为11:1:2
【答案】D
【解析】
![]() ,
,
A.根据化学式NaCl、NaClO、![]() 知,Na、Cl原子个数之比为1:1,所以与NaOH反应的
知,Na、Cl原子个数之比为1:1,所以与NaOH反应的![]() ,故A错误;
,故A错误;
B.假设![]() :
:![]() :3,根据电荷守恒知,
:3,根据电荷守恒知,![]() :
:![]() :
:![]() :3:4,生成3mol氯离子转移电子3mol,生成次氯酸根离子和氯酸根离子的物质的量之和为4mol时,转移电子的物质的量大于3mol,所以转移电子不守恒,故B错误;
:3:4,生成3mol氯离子转移电子3mol,生成次氯酸根离子和氯酸根离子的物质的量之和为4mol时,转移电子的物质的量大于3mol,所以转移电子不守恒,故B错误;
C.氯气和NaOH反应有![]() 、
、![]() ,当生成NaCl和NaClO时转移电子最少,转移电子的物质的量为
,当生成NaCl和NaClO时转移电子最少,转移电子的物质的量为![]() ,当生成NaCl和
,当生成NaCl和![]() 时转移电子最多,转移电子的物质的量为
时转移电子最多,转移电子的物质的量为![]() ,所以如果反应中转移的电子为nmol,则
,所以如果反应中转移的电子为nmol,则![]() ,故C错误;
,故C错误;
D.如果![]() :
:![]() :
:![]() :1:2,得失电子的物质的量之比
:1:2,得失电子的物质的量之比![]() :
:![]() :1,所以得失电子相等,故D正确;
:1,所以得失电子相等,故D正确;
故选:D。


科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.泡沫灭火器的原理:Al3++3HCO3-![]() Al(OH)3↓+3CO2↑
Al(OH)3↓+3CO2↑
C.NH4Cl溶于H2O中:NH4++H2O![]() NH3·H2O+OH-
NH3·H2O+OH-
D.Na2S显碱性原因:S2-+2H2O![]() H2S+2OH-
H2S+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用![]() 表示阿伏加得罗常数,下列说法不正确的是
表示阿伏加得罗常数,下列说法不正确的是
A.对于![]() ,每当新形成
,每当新形成![]() 个
个![]() 键,需要断开
键,需要断开![]() 个
个![]() 键
键
B.![]() 熔融的
熔融的![]() 中含有的阳离子数为
中含有的阳离子数为![]()
C.次氯酸光照分解产生![]() 气体
气体![]() 标准状况
标准状况![]() 转移的电子数为
转移的电子数为![]()
D.电解精炼铜时,若阴极析出32g铜,则转移的电子数为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)常温下向一定体积的0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是___。
A.溶液中导电粒子的数目减少 B.醋酸的电离程度增大,c(H+)亦增大
C.溶液中![]() 不变 D.溶液中
不变 D.溶液中![]() 减小
减小
(2)常温下将0.15mol/L稀硫酸V1mL与0.1mol/L NaOH溶液V2mL混合,所得溶液的pH为1,则V1:V2=___(溶液体积变化忽略不计)。
(3)常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol·L-1,则该溶液的pH可能是___。
(4)常温下,在pH=9的CH3COONa溶液中,由水电离出的OH-浓度___。
(5)电解质水溶液中存在电离平衡、水解平衡,请回答下列问题。
已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数(25℃) | Ka=1.77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
①同浓度HCOONa、NaCN、NaHCO3、Na2CO3这4种溶液中碱性最强的是__;
②体积相同、c(H+)相同的三种酸溶液a.HCOOH;b.HCN;c.HCl分别与同浓度的NaOH溶液完全中和,消耗NaOH溶液的体积由大到小的排列顺序是(填字母) __。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院科研团队研究表明,在常温常压和可见光下,基于LDH(一种固体催化剂)合成NH3的原理示意图如右。下列说法不正确的是

A. 该过程将太阳能转化成为化学能
B. 该过程中,只涉及极性键的断裂与生成
C. 氧化剂与还原剂的物质的量之比为1∶3
D. 原料气N2可通过分离液态空气获得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,该反应中,________是还原剂,________是氧化剂,________是氧化产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是_______(填序号)。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是_______(填序号)。
A.该反应是置换反应
B.反应中NH3被氧化为N2
C.在反应中体现了金属铜的还原性
D.在反应中每生成1 mol H2O转移1 mol电子
(3)在反应H2SO3+2H2S==3H2O+3S↓中被氧化的元素与被还原的元素的质量比______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种不同的物质中均含有同一种元素,它们之间的转化关系如图示(部分反应物及生成物已略去)。下列说法错误的是:
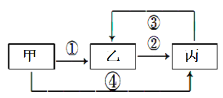
A.若甲为气态氢化物,乙为淡黄色固体,则丙具有漂白性
B.若甲为气体单质,乙为含有极性共价键的非极性分子,则反应②为吸热反应
C.若甲为金属氧化物,乙的水溶液呈酸性,则丙既能与强酸又能与强碱反应
D.若甲为金属单质,反应④为置换反应,则往乙溶液中滴加KSCN,溶液变为血红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )

A. 图1表示1 L pH=2的CH3COOH溶液加水稀释至V L,pH随lg V的变化
B. 图2表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2>T1
C. 图3表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点
D. 图4表示同一温度下,在不同容积的容器中进行反应2BaO2(s) ![]() 2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(s)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.探究“硫代硫酸钠与酸反应速率的影响因素”的实验中,通过观察产生气体的快慢,来反映试剂反应速率的大小,从而探究浓度温度等外界条件对该反应的化学反应速率的影响
B.容量瓶、滴定管上都标有使用温度和“0”刻度;使用前水洗后滴定管还需润洗,而容量瓶不需要润洗
C.油脂皂化反应后的反应液中加入饱和食盐水并搅拌后出现分层,则生成的高级脂肪酸钠在下层
D.只用![]() 溶液就可鉴别出稀盐酸、NaOH溶液、
溶液就可鉴别出稀盐酸、NaOH溶液、![]() 溶液、
溶液、![]() 溶液
溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com