
| A. | 标准状况下22.4 L甲苯含有8NA个C-H键 | |
| B. | 1L1 mol•L-1的Na2S溶液中含有NA个S2- | |
| C. | 46gNa与足量H2O反应完全后可生成NA个H2分子 | |
| D. | 1molCu和少量浓硝酸反应完全后可生成2NA个NO2分子 |
分析 A、标况下甲苯为液体;
B、S2-为弱酸根,在溶液中会水解;
C、求出钠的物质的量,然后根据钠和水反应时,1mol钠反应生成0.5mol氢气;
D、铜和少量浓硝酸反应时,当硝酸变稀后,生成的是NO.
解答 解:A、标况下甲苯为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、S2-为弱酸根,在溶液中会水解,故溶液中S2-的个数小于NA个,故B错误;
C、46g钠的物质的量为2mol,而钠和水反应时,1mol钠反应生成0.5mol氢气,故2mol钠反应后生成1mol氢气即NA个氢气分子,故C正确;
D、铜和少量浓硝酸反应时,当硝酸变稀后,生成的是NO,故生成的NO2的分子个数无法计算,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源: 题型:实验题
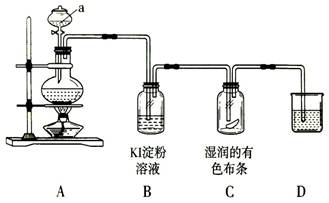
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13g锌与一定量浓硫酸恰好完全反应,生成气体的分子数为0.2NA | |
| B. | 71g氯气通入足量的水中,反应中转移的电子总数为NA | |
| C. | 由D和18O所组成的水11g,所含的中子数为4NA | |
| D. | 1molBrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 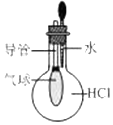 用装置验证 HCl 气体易溶于水 | |
| B. | 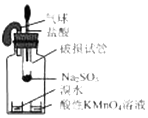 用装置验证 SO2具有漂白性 | |
| C. | 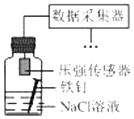 用装置采集到的压强数据判断铁钉发生析氢腐蚀还是吸氧腐蚀 | |
| D. | 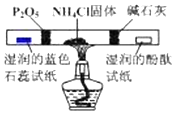 用装置检验 NH4Cl 分解产生的气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ③⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大最共存 | |
| B. | 在含有0.1mol/L Fe3+的溶液中:SCN-、Cl-、K+不能大最共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的Na2O2固体后,CH3COO-变化最小 | |
| D. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com