
分析 (1)(NH4)2SO4 是强酸弱碱盐,NH4+水解显酸性;
(2)加水稀释,一水合氨的电离平衡被促进;
(3)溶液的pH=7,则c(OH-)=c(H+),根据电荷守恒来分析;
(4)根据①③④是强电解质,能完全电离,而②为弱电解质,不能完全电离,并结合②中含2个铵根离子、③④中只含一个铵根离子,且③发生双水解、④中铵根离子的水解被抑制来分析;
(5)溶液②④混合,发生的是NH3•H2O和H+的反应,生成NH4+和水.
解答 解:(1)(NH4)2SO4 是强酸弱碱盐,NH4+水解显酸性:NH4++H2O?NH3•H2O+H+,故答案为:NH4++H2O?NH3•H2O+H+;
(2)加水稀释,一水合氨的电离平衡向右移,即电离被促进,电离出更多的氢氧根,故将溶液②稀释10倍,则稀释后的溶液中c(OH-)大于原来的十分之一,故答案为:大于;
(3)根据电荷守恒可知:c(OH-)+c(CH3COO-)=c(H+)+c(NH4+),而溶液的pH=7,即c(OH-)=c(H+),故有:c(CH3COO-)=c(NH4+),故答案为:=;
(4)根据①③④是强电解质,能完全电离,而②为弱电解质,不能完全电离,故②中c(NH4+)最小;
而②中含2个铵根离子、③④中只含一个铵根离子,故②中c(NH4+)最大;
而③中铵根离子发生双水解、④中铵根离子的水解被抑制,故④中的c(NH4+)大于③,故c(NH4+)由大到小的顺序为①④③②,故答案为:①④③②;
(5)溶液②④混合,发生的是NH3•H2O和H+的反应,生成NH4+和水,离子方程式为:NH3•H2O+H+=NH4++H2O,故答案为:NH3•H2O+H+=NH4++H2O.
点评 本题考查了盐类的水解离子方程式的书写和离子浓度的大小比较,难度不大,应注意在比较离子浓度时电荷守恒的运用.


科目:高中化学 来源: 题型:实验题
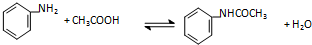
| 物质 | 相对分子质量 | 熔点(℃) | 沸点 | 溶解度(g) | |
| 水 | 乙醇 | ||||
| 苯胺 | 93 | -6 | 184 | 3.42(20℃) | 任意比混溶 |
| 乙酸 | 60 | 17 | 117.9 | 任意比混溶 | 任意比混溶 |
| 乙酰苯胺 | 135 | 114 | 304 | 0.56(20℃) 3.45(50℃) 5.20(100℃) | 36.9(20℃) |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在托盘天平的两托盘中分别放等质量的纸,称取2.0g NaOH固体 | |
| B. | 将NaOH固体在烧杯中溶解后迅速小心转移至250mL容量瓶中 | |
| C. | 定容时不小心加水超过了刻度线,此时迅速用胶头滴管吸出一些 | |
| D. | 摇匀后发现凹液面最底点低于刻度线,再补加蒸馏水到凹液面最底点与刻度线相平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )
如图:A处通入氯气,关闭B阀时,C处干燥红色布条无变化,打开B阀时,C处干燥的红色布条褪色.则下列说法正确的是( )| A. | D中可以盛放浓硫酸 | B. | D中可以盛放饱和食盐水 | ||
| C. | D中可以盛放水 | D. | A处通入的是干燥的氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 依据分子组成中含有氢原子的数目,将酸分为一元酸、二元酸等 | |
| B. | 依据是否有电子转移,将化学反应分为氧化还原反应和非氧化还原反应 | |
| C. | 依据分散质粒子直径的大小,将分散系分为溶液、胶体、浊液 | |
| D. | 依据组成元素的种类,将纯净物分为单质和化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
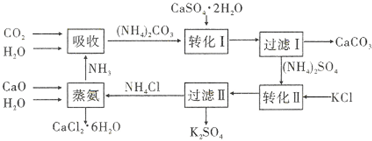
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解的量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com