
分析 混酸溶液加入BaCl2溶液,发生反应H2SO4+BaCl2=BaSO4↓+2HCl,滤液中氢离子物质的量不变,n(H+)=n(HCl)+2n(H2SO4),与NaOH溶液发生反应H++OH-=H2O,由于恰好中和反应,有n(H+)=n(OH-),以此来解答.
解答 解:n(BaCl2)=2mol/L×0.005L=0.01mol,混酸溶液加入BaCl2溶液,发生反应H2SO4+BaCl2=BaSO4↓+2HCl,
则n(H2SO4)=n((BaCl2)=0.01mol,
c(H2SO4)=$\frac{0.01mol}{0.05L}$=0.2mol/L,
滤液中氢离子物质的量不变,n(H+)=n(HCl)+2n(H2SO4),与NaOH溶液发生反应H++OH-=H2O,
由于恰好中和反应,有n(H+)=n(OH-)=0.015L×2mol/L=0.03mol,
n(HCl)=0.03mol-0.01mol×2=0.01mol,
c(HCl)=$\frac{0.01mol}{0.05L}$=0.2mol/L,
答:原混合酸中HCl和H2SO4的物质的量浓度分别为0.2mol/L、0.2mol/L.
点评 本题考查混合物的有关计算,为高频考点,侧重于学生的分析与计算能力的考查,题目难度中等,注意加入氯化钡反应后溶液中氢离子的物质的量不变.


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:解答题
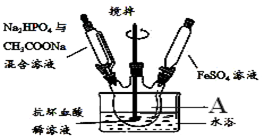 已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;
已知:①抗坏血酸(C6H8O6)(Vc)溶于水和乙醇,具有抗氧化性,可使酸性高锰酸钾溶液褪色;| 梨汁 | 苹果汁 | 橙汁 | 0.04%的Vc溶液 | |
| 滴加的滴数 | 40 | 20 | 10 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(A)=0.15mol/(L•min) | B. | v(B)=0.015 mol/(L•s) | ||
| C. | v(C)=0.40 mol/(L•min) | D. | v(D)=0.45 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L溶液中有阴、阳离子总数为0.8NA | |
| B. | 2L溶液中硝酸根离子浓度为0.4 mol/L | |
| C. | 0.5L溶液中钡离子的浓度为0.2mol/L | |
| D. | 0.5L溶液中含有硝酸根离子的总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成:
肉桂酸(C6H5CH=CHCOOH)是一种常用的香料,可从桂皮中提取,还可用甲苯、氯气等为原料按如下路线合成: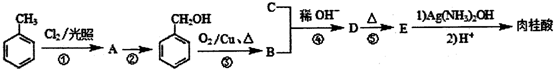
 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2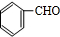 +2H2O.
+2H2O.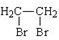
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.6 g CH4中含有的C-H键数目为0.4 NA | |
| B. | 0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA | |
| C. | 加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA | |
| D. | 标准状况下,2.24 L H37Cl含有的中子数为2.0 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
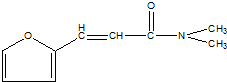 是一种高效麻醉剂,该有机物同分异构体中含有羧基(-COOH)和氨基(-NH2),且苯环上有2个取代基的有(不考虑立体异构)( )
是一种高效麻醉剂,该有机物同分异构体中含有羧基(-COOH)和氨基(-NH2),且苯环上有2个取代基的有(不考虑立体异构)( )| A. | 12种 | B. | 15种 | C. | 18种 | D. | 21种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由溴丙烷水解制丙醇;由丙烯与水反应制丙醇 | |
| B. | 由甲苯硝化制对硝基甲苯;由甲苯氧化制苯甲酸 | |
| C. | 由氯代环己烷消去制环己烯;由丙烯加溴制1,2二溴丙烷 | |
| D. | 由乙酸和乙醇制乙酸乙酯;由乙酸乙酯酯水解得乙酸和乙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com