
����Ŀ����(1)ͼ�ǵ�������Na2CO3��NaHCO3��ĩ�ֱ������������ᷢ����Ӧʱ���龰������CO2���������϶���Թ��м���Ĺ����Լ���_______________������Ӧ����ʱ��A��B���Թ������ĵ�������HCl������֮��Ϊ______________��


(2)ʵ����������ǻ��ܸ��ܵ�Na2CO3�����ᷴӦʱ�Ƿ��ȷ�Ӧ����NaHCO3�����ᷴӦʱ����Ϊ���ȡ���A��B���Թܵķ�Ӧ�����У���Ӧ��ϵ�������仯��������A��Ӧ������ͼ____________��(����m������n��)
(3) �ڻ�����ʱ���£�N2H4��������������������Ӧ���������ֹ㷺���ڵ����������ʣ�д���÷�Ӧ�Ļ�ѧ����ʽ _____________________________________________��
��ij��ȼ�ϵ�صĹ���ԭ��ʾ��ͼ��ͼ��ʾ��a��b��Ϊ���Ե缫��

(1)ʹ��ʱ��������________(����A������B��)��ͨ�롣
(2)����ʹ�õ���ȼ�����Ǽ״�(CH3OH)���ܷ�ӦʽΪ2CH3OH��4OH����3O2= 2CO32-��6H2O����A�ڼ��������Ϊ______________(������)��
(3)a����ӦʽΪ_________________________________________________��
(4)����·��ͨ��0.3 mol����ʱ�����ļ״�������Ϊ_____________g��
���𰸡�NaHCO3 53:84 n 2N2H4��N2O4 = 3N2��4H2O B �״� CH3OH��6e����8 OH��= CO32-��6 H2O 1.6
��������
��
�� ��������Na2CO3��NaHCO3�����ʵ���֮��Ϊ![]() ����NaHCO3�����ʵ����࣬������������ᷴӦʱNaHCO3����������Ҫ�࣬��A�еĹ�����NaHCO3����������NaHCO3��Na2CO3����HCl������֮��Ϊ
����NaHCO3�����ʵ����࣬������������ᷴӦʱNaHCO3����������Ҫ�࣬��A�еĹ�����NaHCO3����������NaHCO3��Na2CO3����HCl������֮��Ϊ![]() ���ʴ�Ϊ��NaHCO3��53:84��
���ʴ�Ϊ��NaHCO3��53:84��
�� NaHCO3�����ᷴӦʱ����Ϊ���ȣ�˵����Ӧ���������С�������������������A��Ӧnͼ�ʴ�Ϊ��n��
���£�N2H4��������������������Ӧ���������ֹ㷺���ڵ����������ʣ�����Ӧ���ɵ�����ˮ����Ӧ�ķ���ʽΪ2N2H4 + N2O4 = 3N2 + 4H2O��
��
�� �ɵ����ƶ������֪aΪ����������������Ӧ��Ӧͨ��ȼ�ϣ�bΪ������������ԭ��Ӧ��Ӧ��B��ͨ��������ʴ�Ϊ��B��
�� �ɵ����ƶ������֪aΪ����������������Ӧ��Ӧͨ��ȼ�ϼ״����ʴ�Ϊ���״���
�� aΪ����������������Ӧ���״�ʧȥ���ӣ��缫��ӦʽΪ��CH3OH - 6e- + 8OH- = CO32- + 6H2O���ʴ�Ϊ��CH3OH - 6e- + 8OH- = CO32- + 6H2O��
�� ���ݵ缫��ӦʽCH3OH - 6e- + 8OH- = CO32- + 6H2O��֪����ת��6mol����ʱ���ļ״�Ϊ1mol����32g�����Ե�ת��0.3mol����ʱ���ĵļ״�Ϊ![]() ���ʴ�Ϊ��1.6��
���ʴ�Ϊ��1.6��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʽ̼��ͭ�������л�������ɱ�����������ͭ�����Ӽ������������̻���������졣CuSO4��Һ��Na2CO3��Һ��Ӧ�ܷ�õ���ʽ̼��ͭ��ij��ͬѧ�������̽����
�������Ʊ���
��ȡ12.5 g��������87.4 mL����ˮ�У���4��ϡ���ᣬ��ֽ����õ�CuSO4��Һ�������м�������Na2CO3��Һ������������ɫ����Һ���ˣ�������ˮϴ�ӣ�������ˮ�Ҵ�ϴ�ӡ�
��1���μ�ϡ����������� ����������ͭ��Һ��������������Ϊ ��
��2������ˮ�Ҵ�ϴ�ӵ�Ŀ���� ��
��ʵ��̽����
ͬѧ�����������װ�ã����Ƶõ�����ɫ�������ʵ�飺

��3��Dװ�ü���ǰ����Ҫ���ȴ���K����Aװ����ȡ����N2��Ȼ��ر�K����ȼD���ƾ��ơ�A�в���N2�������� ��C��ʢװ���Լ�Ӧ�� ��
��4��װ��A�з�����Ӧ�����ӷ���ʽΪ ��
��5��������ɫ��������ΪxCuCO3��yCu(OH)2��ʵ���ܹ۲쵽�������� ��
��6��ͬѧ�Dz�������֪��Ksp[CaCO3]��2.8��10-9��Ksp[BaCO3]��5.1��10-9����������Ϊ��Ҫ��Ba(OH)2����Ca(OH)2�������ⶨ����ɫ����Ļ�ѧʽ����ԭ���� ��
a��Ba(OH)2�ļ��Ա�Ca(OH)2ǿ
b��Ba(OH)2�ܽ�ȴ���Ca(OH)2���ܳ������CO2
c����ͬ�����£�CaCO3���ܽ�����Դ���BaCO3
d�����յ���CO2���ɵ�BaCO3����������CaCO3���������С
��D�з�Ӧ��ȫ����K���ٴεμ�NaNO2��Һ����N2����Ŀ���� ��������������ȡ����ɫ��������Ϊ27.1 g��װ��F��ʹ��Ba(OH)2��Һ��ʵ�������װ��E����������2.7 g��F�в�������19.7 g���������ɫ����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1 L���ܱ������У�������Ӧ4A(��)��3B(��)![]() 2C(��)��D(��)����2 min��B��Ũ�ȼ���0.6 mol��L��1���Դ˷�Ӧ���ʵ���ȷ��ʾ��( )
2C(��)��D(��)����2 min��B��Ũ�ȼ���0.6 mol��L��1���Դ˷�Ӧ���ʵ���ȷ��ʾ��( )
A. ��A��ʾ�ķ�Ӧ������0.4 mol��L��1��min��1
B. ��B��C��D�ֱ��ʾ��Ӧ�����ʣ����ֵ��3��2��1
C. �ڵ�2 minĩ�ķ�Ӧ������B��ʾ��0.3 mol��L��1��min��1
D. �ٹ�2 min��B��Ũ���Լ���0.6 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Ҫ����A12O3��Fe2O3��FeO��SiO2���������Ʊ���ˮ������KAl(SO4)2��12H2O�Ͳ�Ѫ��FeSO4��7H2O��������������(���ֲ����Ͳ�����ȥ)��
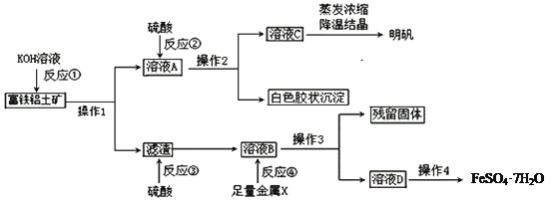
(1)����1����Ҫ�õ��IJ�������______________________��
(2)��Ӧ�٢ڢۢ�����������ԭ��Ӧ����_________����д��ţ���
(3)�ۺϿ��ǣ�����X���ѡ��__________��д���÷�Ӧ���ӷ�����ʽ_________________________��
(4)��Ӧ�ٵ����ӷ���ʽ��___________________��___________________________��
(5)��ҺD�к��еĽ�����������_______�����鷽����_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CoCl26H2O��һ������Ӫ��ǿ����������ˮ�ܿ�[��Ҫ�ɷ�ΪCo2O3��Co��OH��3������������Fe2O3��Al2O3��MnO��]��ȡ���乤���������£�
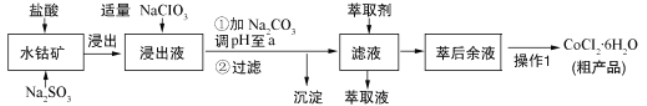
��֪��������Һ�к��е���������Ҫ��H+��Co2+��Fe2+��Mn2+��Al3+�ȣ�
�������в���������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
��ʼ���� | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
��ȫ���� | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
��CoCl26H2O�۵�Ϊ86����������110��120��ʱ��ʧȥ�ᾧˮ����CoCl2��
�ش��������⣺
��1������ˮ�ܿ��������Fe2O3������Ӧ�Ļ�ѧ����ʽΪ________________________��
��2�������Һ�м�������NaClO3Ŀ����______________________________________��
��3������Na2CO3��pH��a����a=______���������ó�������Ҫ�ɷ�Ϊ_________���ѧʽ����
��4����ȡ���Խ������ӵ���ȡ����ҺpH�Ĺ�ϵ����ͼ��ʾ��������Һ���м������ȡ����Ŀ����__________��ʹ�ø���ȡ�������pH��Χ��_____����ѡ����ĸ��
A. 5.0��5.5 B. 4.0��4.5 C. 3.0��3.5 D. 2.0��2.5
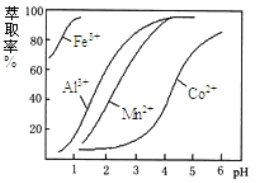
��5��ʵ�����������1��Ϊ_______________��_________�����˺ͼ�ѹ������Ƶõ�CoCl26H2O�ں��ʱ���ѹ��ɵ�ԭ����________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б���������ǣ� ��
A. CS2�ĽṹʽΪ��S��C��S
B. 6CO2��6H2O![]() C6H12O6��6O2 ���ñ仯�й���ֱ��ת��Ϊ��ѧ��
C6H12O6��6O2 ���ñ仯�й���ֱ��ת��Ϊ��ѧ��
C. CO2��g����C��s��![]() 2CO��g����H��0����S��0���÷�Ӧ���������Է�����
2CO��g����H��0����S��0���÷�Ӧ���������Է�����
D. NH3ˮ��Һ�ʼ��Ե�ԭ����NH3��H2O![]() NH3��H2O
NH3��H2O![]() NH4����OH��
NH4����OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��������ʵ�������д��ȷ���ǣ� ��
A. �������缫��ⱥ���Ȼ�����Һ��2Cl����2H2O![]() 2OH����H2����Cl2��
2OH����H2����Cl2��
B. ���������ɳ���ص�������Ӧ��NiO(OH)��e����H2O==Ni(OH)2��OH��
C. ����ˮ��ʹ��̪��Һ��죺C17H35COO����H2O![]() C17H35COOH��OH��
C17H35COOH��OH��
D. ��֪����������Ա�̼��ǿ���� ��Һ��ͨ�����CO2��
��Һ��ͨ�����CO2�� �� 2CO2 �� 2H2O ����
�� 2CO2 �� 2H2O ����![]() �� 2HCO3-
�� 2HCO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в����в�������ȡ����
A. ����������ȡ������ B. ����ˮ����ȡ�嵥��
C. ����ҩ�� D. ��ˮ����ȡʳ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���һ��2 L���ܱ������У�����4 mol A��2 mol B�������·�Ӧ��3A(g)+2B(g)![]() 4C(s)+2D(g)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C������˵����ȷ��
4C(s)+2D(g)����Ӧһ��ʱ���ﵽƽ�⣬�������1.6 mol C������˵����ȷ��
A. �÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽ��![]()
B. ��ʱB��ƽ��ת������40%
C. �������ϵ��ѹǿ��ƽ�������ƶ�����ѧƽ�ⳣ������
D. ����B��ƽ�������ƶ���B��ƽ��ת��������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com