

分析 (1)结合影响反应速率的因素分析考虑;
(2)反应2SO2+O2$?_{加热}^{催化剂}$2SO3是放热反应,可结合平衡的移动因素分析各图象;
(3)2SO2+O2$?_{加热}^{催化剂}$2SO3
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 1.8 0.9 1.8
平衡浓度(mol/L) 0.2 0.1 1.8
结合平衡常数的计算公式和影响平衡常数的因素分析;
(4)25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,浓硫酸溶解于水是放热过程.
解答 解:(1)反应物的接触面积大了,反应的速度就快了,则将硫铁矿粉碎后再进行生产,增大硫铁矿与氧气的接触面,使反应更充分,另外用过量空气煅烧硫铁矿,反应物浓度增大平衡正向移动,有利于提高硫铁矿的利用率,
故答案为:将硫铁矿粉碎;用过量空气煅烧硫铁矿;
(2)A.当反应达到平衡后,随温度的升高,平衡逆向移动,SO2的转化率降低,故A错误;B.增大压强有利于平衡正向移动,SO2的转化率增加,故B正确;C.增大氧气的浓度可促进平衡正向移动,SO2的转化率升高,故B正确;D.使用催化剂反应速率加快,但平衡不移动,SO2的转化率不变,故D错误;
故答案为:BC;
(3)2SO2+O2$?_{加热}^{催化剂}$2SO3
起始浓度(mol/L) 2 1 0
变化浓度(mol/L) 1.8 0.9 1.8
平衡浓度(mol/L) 0.2 0.1 1.8
则该反应的平衡常数K=$\frac{{c}^{2}(S{O}_{3})}{{c}^{2}(S{O}_{2})×c({O}_{2})}$=$\frac{1.{8}^{2}}{0.{2}^{2}×0.1}$=81,
平衡常数只受温度影响,温度升高,此反应平衡逆向移动,平衡常数减小,
故答案为:81;减小;
(3)中和热是强酸强碱稀溶液完全反应生成1mol水放出的热量,一定量98%的浓硫酸、10%的稀硝酸、10%的盐酸分别与NaOH溶液生成1mol水,发生中和反应放出的热量57.3kJ,98%浓硫酸溶解于水放热,实际反应放热大于57.3kJ,反应焓变是负值,所以△H1<△H2=△H3;
故答案为:△H1<△H2=△H3.
点评 主要考查影响反应速率的因素,化学平衡的计算及影响平衡的因素、中和热的误差分析等,属基础考查,难度中等.


 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案科目:高中化学 来源:2017届江西省高三上学期第三次月考化学试卷(解析版) 题型:选择题
建设“碧水蓝天”的生态城市,下列措施中不合理的是( )
A.加高烟囱,减少烟尘对周围环境的影响
B.大力实施矿物燃料“脱硫、脱硝技术”,减少硫的氧化物和氮的氧化物污染
C.积极推广太阳能、风能等新能源的使用,减少化石燃料的 使用
使用
D.加强城市生活污水脱氮除磷处理,遏制水体富营养化
查看答案和解析>>
科目:高中化学 来源:2017届贵州省高三上学期第二次月考化学试卷(解析版) 题型:选择题
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+SO2+2H2O=H2SO4+2HBr的反应原理相似,且水的作用也相同的是
A.2AlCl3+3Na2S+6H2O=2Al(OH)3↓+3H2S↑+6NaCl
B.2F2+2H2O=4HF+O2↑
C.2Na2O2+2H2O=4NaOH+O2↑
D.2Al+2NaOH+2H2O=2NaAlO2+3H2↑
查看答案和解析>>
科目:高中化学 来源:2017届甘肃省高三上学期期中化学试卷(解析版) 题型:选择题
下列实验操作能达到实验目的的是
A. 用长颈漏斗分离出乙酸与乙醇反应的产物
B. 用向上排空气法收集铜粉与稀硝酸反应产生的NO
C. 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2
D. Cl2配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省绵阳市高一上第一次月考化学试卷(解析版) 题型:选择题
实验室进行NaCl溶液蒸发时,一般有以下操作过程 ①放置酒精灯 ②固定铁圈位置③放上蒸发皿 ④加热搅拌 ⑤停止加热、余热蒸干 其正确的操作顺序为
A. ②③④⑤ B. ①②③④⑤ C. ②③①④⑤ D. ②①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 | 4.7 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
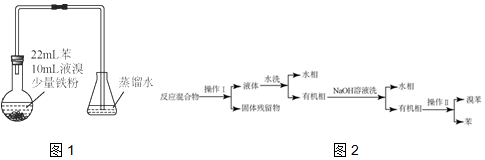
 .
.| 序号 | 实验步骤 | 预期现象 | 结论 |
| 1 | |||
| 2 | 锥形瓶中液体含大量 | ||
| 3 | 锥形瓶中液体含大量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )
室温下,用0.100mol•L-1的NaOH溶液分别滴定均为20.00mL0.100mol•L-1的HCl溶液和醋酸溶液,滴定曲线如图所示.下列说法正确的是( )| A. | I表示的是滴定醋酸的曲线 | |
| B. | pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL | |
| C. | V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-) | |
| D. | V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com