
【题目】将30mL5mol/L NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
A. 0.3 mol/L B. 3 mol/L C. 0.15 mol/L D. 1.5 mol/L
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O 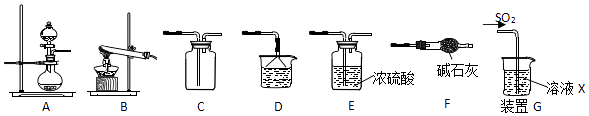
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为 .
(2)D中盛装的试剂为 .
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的 , 可观察到的现象 .
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中, .
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种物质均易溶于水,分别按下列条件配成溶液,其中物质的量浓度最大的是( )
A.10 mL 5molL﹣1的A溶液加水配制成100 mL溶液
B.9.2 g B物质(式量为46)溶于水配成100 mL溶液
C.1.806×1023个C的分子溶于水配成100 mL溶液
D.0.1 moL D物质溶于100 mL 2.5 molL﹣1的D溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)Ni(CO)4(g),已知该反应平衡常数与温度的关系如表:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10﹣5 |
下列说法不正确的是( )
A.上述生成Ni(CO)4(g)的反应为放热反应
B.25℃时反应Ni(CO)4(g)Ni(s)+4CO(g)的平衡常数为2×10﹣5
C.在80℃时,测得某时刻,Ni(CO)4(g)、CO浓度均为0.5 mol/L,则此时v(正)>v(逆)
D.80℃达到平衡时,测得n(CO)=0.15mol,则Ni(CO)4的平衡浓度为0.125 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:实验室可供选择的用于去除气体杂质的试剂有:浓硫酸、无水氯化钙、五氧化二磷、碱石灰(主要成分为NaOH和CaO)
①实验室用如图1所示装置进行纯净干燥的氢气还原氧化铁实验.a装置名称为 , 方框B内应选用如图2装置(填“Ⅰ”或“Ⅱ”),选用的除杂试剂为(填试剂名称).
②实验室常用36.5%浓盐酸(ρ=1.2gcm﹣3)配制稀盐酸,若要配制500mL,0.5molL﹣1稀盐酸,需用量筒取用浓盐酸mL.
③写出装置C中发生反应的化学方程式并用单线桥标明电子的转移 . 实验结束时应该采取的操作是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是( )
A.向硫酸铜蓝色溶液中加入BaCl2溶液:Ba2++SO42﹣═BaSO4↓
B.碳酸氢钙溶液跟盐酸反应:Ca(HCO3)2+2H+=Ca2++2H2O+2CO2↑
C.锌与盐酸的反应:Zn+2H++2Cl﹣═Zn2++2Cl﹣+H2↑
D.向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O ![]() Fe(OH)3↓+3H+
Fe(OH)3↓+3H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BF3是典型的平面三角形分子,它溶于氢氟酸或NaF溶液中都形成BF4-离子,则BF3和BF4-中的B原子的杂化轨道类型分别是( )
A.sp2、sp2
B.sp3、sp3
C.sp2、sp3
D.sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】青蒿素是一种高效、速效抗疟药,是中医药献给世界的一份礼物.屠呦呦因在发现、研究青蒿素方面做出的杰出贡献而获得2015年诺贝尔医学奖.青蒿素分子结构如图,下列说法中正确的是( ) 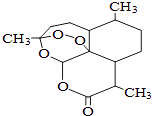
A.青蒿素能与热的NaOH溶液反应
B.青蒿素的分子式为C15H21O5
C.青蒿素分子结构中只含有极性键
D.青蒿素能使酸性KMnO4溶液、溴的CCl4溶液分别褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com