
【题目】为了探究某带结晶水的固体X(含四种短周期元素)的组成和性质,设计并完成如下实验

请回答:(1)白色固体D是________。
(2)无色溶液![]() 白色沉淀F的离子方程式是________。
白色沉淀F的离子方程式是________。
(3)X的化学式是________。
【答案】![]() (或氧化镁)
(或氧化镁) ![]() MgC2O4
MgC2O4![]() 4H2O
4H2O
【解析】
混合气体A经过浓硫酸得混合气体B,B在标况下体积为896mL,物质的量为0.04mol,混合气体B通入澄清的石灰水,产生白色沉淀为CaCO3,白色沉淀的质量为2.00g,则物质的量为0.02mol,所以n(CO2)=0.02mol,根据框图可知含n(CO)=0.02mol,所以含C的物质的量为0.04mol。由框图加入足量的氢氧化钠,产生白色沉淀F为1.16g,可知白色沉淀F为Mg(OH)2,物质的量为n[Mg(OH)2]=![]() =0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=
=0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=![]() =40g/mol,所以D为MgO,所以n(MgO)=0.02mol,含O为0.02mol,根据质量守恒,m=0.02mol
=40g/mol,所以D为MgO,所以n(MgO)=0.02mol,含O为0.02mol,根据质量守恒,m=0.02mol![]() 40g/mol+0.02mol
40g/mol+0.02mol![]() 44g/mol+0.02mol
44g/mol+0.02mol![]() 28g/mol=2.24g,所以水的质量为:2.96g-2.24g=0.72g,水的物质的量为n(H2O)=0.04mol,含n(H)=0.08mol。
28g/mol=2.24g,所以水的质量为:2.96g-2.24g=0.72g,水的物质的量为n(H2O)=0.04mol,含n(H)=0.08mol。
(1)由框图加入足量的氢氧化钠,产生白色沉淀F为1.16g,可知白色沉淀F为 Mg(OH)2,物质的量为n[Mg(OH)2]=![]() =0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=
=0.02mol,n(Mg2+)=0.02mol,白色固体D的摩尔质量为M=![]() =40g/mol,所以D为MgO;答案:MgO。
=40g/mol,所以D为MgO;答案:MgO。
(2)由框图可知MgO与盐酸反应生成无色溶液E为MgCl2,无色溶液与足量的氢氧化钠,产生白色沉淀F为Mg(OH)2,反应的的离子方程式是:Mg2++ 2OH-= Mg(OH)2![]() ,答案:Mg2++ 2OH-= Mg(OH)2
,答案:Mg2++ 2OH-= Mg(OH)2![]()
(3)由上述分析可知X中含Mg、C、O、H的物质量的比为:0.02mol:0.04mol:0.10mol:0.08mol=1:2:5:4,所以X的化学式是MgC2O4![]() 4H2O;答案:MgC2O4
4H2O;答案:MgC2O4![]() 4H2O。
4H2O。


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】将a g二氧化锰粉末加入b mol/L的浓盐酸c L中加热完全溶解,反应中转移电子d个,设NA为阿伏加德罗常数的值,下列叙述正确的是
A.可以收集到氯气![]() L
L
B.NA可表示为:![]()
C.反应后溶液中的Cl―数目为:![]()
D.反应后溶液中的H+数目为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在373K时,把0.1molN2O4气体通入体积为lL的恒容密闭容器中,立即出现红棕色。在60s时,体系已达平衡,此时容器内压强为开始时的1.6倍。下列说法正确的是( )
A.压缩容器,颜色变浅
B.在平衡时体系内含N2O40.04mol
C.以N2O4的浓度变化表示的平均反应速率为0.002mol/(L·s)
D.平衡时,如果再充入一定量N2O4,则可提高N2O4的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式中正确的是![]()
A.稀硝酸与过量的铁屑反应:![]()
B.硫酸铝溶液与过量的氨水反应:![]()
C.苯酚钠的水溶液中通入少量的![]() :
:![]()
D.醋酸钠的水解反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人类的农业生产离不开氮肥,几乎所有的氮肥都以氨为原料,某化学兴趣小组利用图一装置制备氨气并探究相关性质。
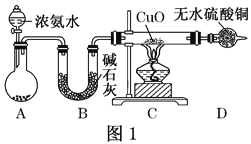
(1)装置A中,盛有浓氨水的仪器名称为_____,烧瓶内药品可选用______。装置B的作用是______。
(2)连接好装置并检验装置的气密性后,装入药品,然后应先_____(填I或Ⅱ)。
Ⅰ.打开旋塞逐滴向圆底烧瓶中加入氨水 Ⅱ.加热装置C
(3)实验中观察到C中CuO粉末变红,D中无水硫酸铜变蓝,并收集到一种单质气体,则该反应相关化学方程式为______,该反应证明氨气具有______性;氨跟氧气的反应也体现了这一性质,反应方程式为______。
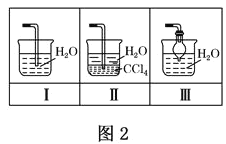
(4)该实验缺少尾气吸收装置,图二中能用来吸收尾气的装置是_____(填装置序号)。
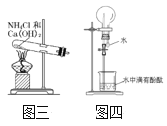
(5)实验室还可用图三所示装置制备氨气,化学反应方程式为_____;用圆底烧瓶收集干燥的氨气,用图四装置进行喷泉实验,挤压胶头滴管时,可以得到红色喷泉,原因(用方程式表示)是______。
(6)尿素CO(NH2)2是一种常用化肥,缓慢与水发生非氧化还原反应释放出氨气,则尿素中C的化合价为价_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元酸H2A的电离方程式为:H2A=H++HA-,HA-![]() H++A2-,下列有关该酸及盐的说法正确的是
H++A2-,下列有关该酸及盐的说法正确的是
A.0.1 mol/LH2A溶液pH=1
B.H2A为强酸
C.NaHA溶液呈酸性的原因是:HA-+H2O![]() H2A+OH-
H2A+OH-
D.Na2A在溶液中不水解,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图:

(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。通常用来酸化高锰酸钾的酸是______
A.H2SO4 B.HCl C.HNO3
(2)除去滤液1中Cu2+的离子方程式是___________________________
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中![]() <0.7时,滤液1中能够检验出有Fe2+;
<0.7时,滤液1中能够检验出有Fe2+;![]() ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①②:
①检验Fe2+是否氧化完全的实验试剂是__________ A.KSCN B.K3Fe(CN)6
②若![]() >1,调节
>1,调节![]() 到0.7~1的最理想试剂是_______(填序号)
到0.7~1的最理想试剂是_______(填序号)
a.NaOH溶液 b.铁粉 c.MnO。
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式__________。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1 mol O2的体积是22.4 L
B.1.7 g NH3中含有的质子数约为6.02×1023
C.8 g S在足量O2中完全燃烧转移的电子数约为3.01×1023
D.0.5 mol·L1NaCl溶液中含有Cl的物质的量为0.5 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100 mL FeBr2溶液中通入标准状况下2.24 L Cl2,溶液中有![]() 的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
的Br-被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为( )
A.4 mol L-1B.![]() mol L-1C.
mol L-1C.![]() mol L-1D.
mol L-1D.![]() mol L-1
mol L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com