
【题目】由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。

(1)聚合物F的结构简式是____________。
(2)D的结构简式是________________。
(3)B转化为C的化学方程式是_____________________。
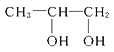
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环化合物,该化合物的结构简式是_____________________________________。
(5)E有多种同分异构体,其中一种能发生银镜反应,1mol该种同分异构体与足量的金属钠反应产生1mol H2,则该种同分异构体为_____________________________________。
【答案】 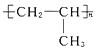
 +O2
+O2![]()
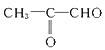 +H2O
+H2O 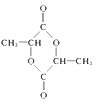 HOCH2CH(OH)CHO
HOCH2CH(OH)CHO
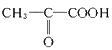
【解析】本题考查有机物的推断和合成,(1)丙烯中含有碳碳双键,能发生加聚反应,因此F的结构简式为: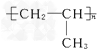 ;(2)丙烯与Br2发生加成反应,则A的结构简式为CH3CHBrCH2Br,A在氢氧化钠水溶液中发生水解反应,即B的结构简式为CH3CH(OH)CH2OH,B发生氧化反应,C的结构简式为:
;(2)丙烯与Br2发生加成反应,则A的结构简式为CH3CHBrCH2Br,A在氢氧化钠水溶液中发生水解反应,即B的结构简式为CH3CH(OH)CH2OH,B发生氧化反应,C的结构简式为:![]() ,C中醛基进一步被氧化成羧基,即D的结构简式为
,C中醛基进一步被氧化成羧基,即D的结构简式为![]() ;(3)根据(2)的分析,即B生成C的化学反应方程式为:
;(3)根据(2)的分析,即B生成C的化学反应方程式为: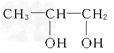 +O2
+O2![]()
![]() +H2O;(4)D是羰基与氢气发生加成反应,即E的结构简式为CH3CH(OH)COOH,两分子E通过酯化反应,生成环状化合物,即为
+H2O;(4)D是羰基与氢气发生加成反应,即E的结构简式为CH3CH(OH)COOH,两分子E通过酯化反应,生成环状化合物,即为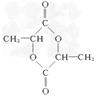 ;(5)能发生银镜反应,说明含有醛基,与足量钠反应,根据E的分子式,1mol同分异构体中含有2mol羟基,因此同分异构体为HOCH2CH(OH)CHO。
;(5)能发生银镜反应,说明含有醛基,与足量钠反应,根据E的分子式,1mol同分异构体中含有2mol羟基,因此同分异构体为HOCH2CH(OH)CHO。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是
A. Na与水反应:2Na+2H2O=2Na++2OH-+H2↑
B. FeCl3腐蚀电路板:Fe3++Cu=Fe2++Cu2+
C. 向Mg(OH)2中加入盐酸:OH-+H+=H2O
D. Cl2与水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铵是化工、染织、医药、皮革等工业原料。某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如下:
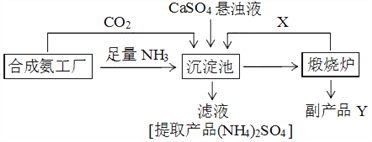
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是_____
A.电离方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+ O2 ![]() 2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为___________。
(4)副产品Y是__。沉淀池中发生的主要反应方程式是___________________。
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列有关叙述正确的是
A. 在含A13+总数为NA的A1C13溶液中,C1-总数为3NA
B. 标准状况下,5.6L CO2中含有的共用电子对数为0.5NA
C. Na2O2与足量的CO2反应生成0.1mol O2,转移的电子数为0.2NA
D. 常温下,56g铁片投入足量浓H2SO4中,充分反应,生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:
(1)下列说法正确的是_________

A.图1为实验室制备硝基苯的装置
B.图2可以用于测定乙醇分子结构
C.图3装置可以达到验证酸性:CH3COOH > H2CO3 > C6H5OH的目的
D.图4装置可以达到验证溴乙烷发生消去反应生成烯烃的目的
(2)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为____________________。
②滴定终点的现象是___________________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L—1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为________________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果__________(填“偏大”“偏小”或“无影响”)。
⑤工业上由H4TiO4可制得钛白粉TiO2。TiO2直接电解还原法生产钛是一种较先进的方法,电解质为熔融的CaCl2,原理如图所示,阴极的电极反应为_________。

(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与Cr![]() 生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为______mol·L-1,此时溶液中c(Cr
生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×10-5 mol·L-1)时,溶液中c(Ag+)为______mol·L-1,此时溶液中c(Cr![]() )等于_______mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
)等于_______mol·L-1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×10-12和2.0×10-10)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于晶体说法的正确组合是

①分子晶体中都存在共价键
②在晶体中只要有阳离子就一定有阴离子
③金刚石、SiC、NaF、NaCl、H2O、H2S晶体的熔点依次降低
④离子晶体中只有离子键没有共价键,分子晶体中肯定没有离子键
⑤CaTiO3晶体中(晶胞结构如上图所示)每个Ti4+和12个O2-紧邻
⑥SiO2晶体中每个硅原子与两个氧原子以共价键相结合
⑦晶体中分子间作用力越大,分子越稳定
⑧氯化钠熔化时离子键被破坏
A.①②③⑥ B.①②④
C.③⑤⑦ D.③⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】具有抗菌作用的白头翁素衍生物H的合成路线如下图所示:

已知:
i. ![]()
ii. 
iii. 
(以上R、R、R''代表氢、烷基或芳基等)
(1)A属于芳香烃,其名称是____________。
(2)B所含官能团的名称是____________。
(3)由C生成D的化学方程式是_______________________________________。
(4)由G生成H的反应是_______反应,1mol F与足量NaOH溶液反应,消耗_______molNaOH。
(5)与 互为同分异构体,且符合下列条件的有机物有_________种。
互为同分异构体,且符合下列条件的有机物有_________种。
①与 含有相同的官能团
含有相同的官能团
②酸性条件下的水解产物能使FeCl3溶液显紫色
③苯环上只有两个取代基
(6)以乙烯为起始原料,结合己知信息选用必要的无机试剂合成CH3CH=CHCH3,写出合成路线______(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com