
【题目】Fe是人体不可缺少的微量元素,摄入含铁化合物可补充铁。硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量。实验步骤如下:
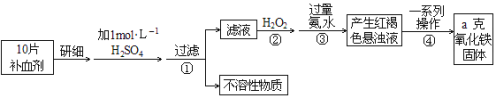
请回答下列问题:
(1)步骤②加入过量H2O2的目的:________________________________________;
(2)步骤③中反应的离子方程式:________________________________________;
(3)步骤④中一系列处理的操作步骤:________、洗涤、______、冷却、称量。
(4)实验中用浓硫酸配制1 mol/L的稀硫酸,配制时用到的定量玻璃仪器有________、__________。
(5)若实验无损耗,则每片补血剂含铁元素的质量___________g(用含a的代数式表示)。
【答案】将Fe2+全部氧化成Fe3+Fe3++3NH3H2O=Fe (OH)3↓+3NH4+过滤灼烧容量瓶量筒0.07a
【解析】
由流程图可知:将药品中的Fe2+形成溶液,将Fe2+氧化为Fe3+,使Fe3+转化为氢氧化铁沉淀,再转化为氧化铁,通过测定氧化铁的质量,计算补血剂中铁元素的含量.(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+,由流程图可知,加入H2O2是将Fe2+氧化为Fe3+;(2)步骤③是将Fe3+转化为氢氧化铁沉淀;(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;(4)配制一定体积的1mol·L-1的稀硫酸,配制时需要的仪器有量筒、玻棒、烧杯、胶头滴管,容量瓶;
(1)双氧水具有氧化性,酸性条件下能将Fe2+全部氧化为Fe3+;(2)步骤③是将Fe3+转化为氢氧化铁沉淀,反应离子方程式为Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+;(3)步骤④中一系列处理是由氢氧化铁悬浊液最终转化为氧化铁,需要过滤、洗涤的氢氧化铁,然后灼烧生成氧化铁,冷却后称量氧化铁的质量;(4)配制一定体积的1mol·L-1的稀硫酸,配制时需要的仪器有玻棒、烧杯、胶头滴管、容量瓶、量筒,故答案为:容量瓶;量筒;(5)ag氧化铁中铁元素的质量即为10片补血剂中铁的质量,所以每片补血剂含铁元素的质量
ag×112/160/10=0.07ag,故每片补血剂含铁元素的质量为:0.07a.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钠与水反应的离子方程式正确的是( )
A.2Na+3H+═2Na++H2↑
B.Na+H2O═Na++OH﹣+H2↑
C.2Na+2H2O═2Na++2OH﹣+H2↑
D.2Na+2H2O═2Na++O2↑+2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,某容器中加入足量的碳酸钙,发生反应CaCO3(s)![]() CaO(s)+CO2(g),达到平衡,下列说法正确的是
CaO(s)+CO2(g),达到平衡,下列说法正确的是
A. 将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度不变
B. 将体积增大为原来的2倍,再次达到平衡时,气体的密度变大
C. 因CaCO3(s)需加热条件才分解生成CaO(s)和CO2(g),所以是△H<0
D. 保持容器压强不变,充入He,平衡向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数值为NA,下列说法中正确的是
A. 一定条件下3.2gSO2与足量O2反应转移电子数为0.1NA
B. 2.9g异丁烷和正丁烷混合物含有C-H键数目为0.5NA
C. 50mL12mol/L浓盐酸与足量MnO2共热转移电子数0.3NA
D. 标准状况下,3.36L三氯甲烷中含有氯原子0.45NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废铅蓄电池填料(主要成分为PbO2、PbO、PbSO4等)作阴极,采取固相直接电解法可提取金属Pb,其装置如图所示(已知:PbSO4+3OH-=HPbO2-+S042-+H2O)。下列说法中错误的是

A. b与外接电源的负极相连
B. PbO2放电时电极反应式为:PbO2+4e-+2H2O=Pb+40H-
C. 电解过程中左室水的电离程度减弱(忽略溶液温度变化)
D. 与传统无膜电解法相比,该电解方法可提高铅元素利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 油脂都不能使溴水褪色
B. 氨基酸是两性化合物,能与酸、碱反应生成盐
C. 福尔马林可用作食品防腐剂
D. 蔗糖和麦芽糖的水解产物都是葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率;
(3)2 min末SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2012年6月16日18时37分24秒,神舟九号成功发射。飞船的能量部分来自太阳能电池,另外内部还配有高效的MCFC型燃料电池。该燃料电池可同时供应电和水蒸气,其所用燃料为氢气,电解质为熔融的碳酸钾。已知该燃料电池的总反应为2H2+O2===2H2O,负极反应为H2+CO![]() -2e-===CO2↑+H2O,则下列推断正确的是( )
-2e-===CO2↑+H2O,则下列推断正确的是( )
A.电池工作时,CO![]() 向负极移动
向负极移动
B.电池放电时,电子经外电路由通氧气的正极流向通氢气的负极
C.正极的电极反应式为4OH--2e-===O2↑+2H2O
D.通氧气的电极为正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列根据反应原理设计的应用,不正确的是( )
A. CO32-+H2O![]() HCO3-+OH- 与Al2(SO4)3溶液混合作灭火剂
HCO3-+OH- 与Al2(SO4)3溶液混合作灭火剂
B. Al3++3H2O![]() Al(OH)3+3H+ 明矾净水
Al(OH)3+3H+ 明矾净水
C. TiCl4+(x+2)H2O(过量) ![]() TiO2·xH2O↓+4HCl 制备TiO2纳米粉
TiO2·xH2O↓+4HCl 制备TiO2纳米粉
D. SnCl2+H2O![]() Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入浓盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com