
时间s 浓度mol/L | 0 | 20 | 40 | 60 | 80 | 100 |
| c(N2O4) | 0.100 | c1 | 0.050 | c3 | a | b |
| c(NO2) | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
| △c |
| △t |
| c2(NO2) |
| c(N2O4) |
| 0.06mol/L |
| 0.1mol/L |
| 0.03mol/L |
| 20S |
| c2(NO2) |
| c(N2O4) |
| (0.12mol/L)2 |
| 0.040mol/L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
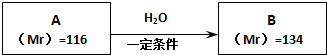
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:
如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| 检测次数 | 溶液中检测出的物质 |
| 第一次 | KCl、K2SO4、Na2CO3、NaCl |
| 第二次 | KCl、BaCl2、Na2SO4、K2CO3 |
| 第三次 | Na2SO4、KCl、K2CO3、NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量(毫克) | 255 | 385 | 459 |
| 生成气体体积(毫升) | 280 | 336 | 336 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(H+)=c(A-)+c(OH-) |
| D、c(Na+)+c(OH-)=c(A-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
| 加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.9 mol/L |
| B、0.45 mol/L |
| C、0.6 mol/L |
| D、0.55 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎碰翻燃着的酒精灯失火,应立即用湿布灭火 |
| B、不慎将酸沾到皮肤或衣物上,应立即用浓NaOH清洗 |
| C、用托盘天平称量物品质量时,物品应置于右盘 |
| D、实验时应节约药品,实验剩余的药品应放回原试剂瓶 |
| E、可燃性气体点燃前一定要验纯 |
| F、使用分液漏斗前须检查其是否漏水 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com