
分析 明矾的化学式为KAl(SO4)2•12H2O,明矾为1mol,则溶液中含有1molAl3+,2molSO42-,SO42-全部转化为BaSO4沉淀,发生Al3++4OH-+SO42-+Ba2+=BaSO4↓+AlO2-+2H2O;当滴入的氢氧化钡溶液中含氢氧化钡1mol时,发生SO42-+Ba2+=BaSO4↓、Al3++3OH-=Al(OH)3↓,以此来解答.
解答 解:含有1mol明矾的溶液中,当SO42-沉淀完全时,发生Al3++4OH-+SO42-+Ba2+=BaSO4↓+AlO2-+2H2O,生成氢氧化铝沉淀的质量为0;
当滴入的氢氧化钡溶液中含氢氧化钡1mol时,碱不足,由Al3++3OH-=Al(OH)3↓可知,生成氢氧化铝沉淀的质量为1mol×$\frac{1}{3}$×78g/mol=26g,
故答案为:0;Al3++4OH-+SO42-+Ba2+=BaSO4↓+AlO2-+2H2O;26.
点评 本题考查物质的量计算,为高频考点,把握发生的反应、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意与量有关的反应,题目难度不大.


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤是工业上获得苯、甲苯、二甲苯等芳香烃的重要来源 | |
| B. | 煤是由多种有机化合物组成的混合物,内含煤焦油等成分 | |
| C. | 煤除了含有C、H元素外,还含有少量的N、S、O等元素 | |
| D. | 煤等化石燃料的储量有限,节能和开发新能源是人类实现可持续发展的关键之一 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将 SO2 通入水中 | B. | 将 HCl 通入水中 | C. | 烧碱溶于水 | D. | 硫酸氢钾溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.0 mol•L-1KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | $\frac{{c({H^+})}}{{c(O{H^-})}}={10^{-10}}$的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Cl-、SO42-、CO32- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、I-、S2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.
下表是元素周期表的一部分.表中所列的字母分别代表一种化学元素.| a | |||||||||||||||||
| b | c | d | e | f | |||||||||||||
| g | h | i | j | k | l | m | |||||||||||
| n | o | ||||||||||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
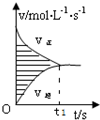 在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )
在容积为 4L 的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)?3Z(g)并达到平衡.在此过程中以 Y 的浓度改变表示的反应速率 v 正、v 逆与时间 t 的关系如图所示,则以下信息正确的是( )| A. | 反应起始时,X、Y、Z 三种物质同时存在 | |
| B. | t1 时刻,X、Y、Z 浓度不再发生变化,反应停止 | |
| C. | 若该反应在更大的压强下进行,达平衡时,阴影部分面积不变 | |
| D. | 若该反应在加入催化剂的条件下进行,达平衡时,阴影部分面积不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com