
肼(N2 H4)是一种可用于火箭或原电池的燃料。已知:
N2(g)+2O2(g)=2NO2(g) △H=+67.7 kJ/mol ①
N2 H4(g)+O2(g)=N2(g)+2H3O(g) △H=-534 kJ/mol ②
下列说法正确的是
| A.反应①中反应物所具有的总能量大于生成物所具有的总能量 |
| B.2N2 H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=-1000.3 kJ/mol |
| C.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,其负极反应式为N2H4-4e-+4OH-=N2+4H2O |
| D.铂作电极,KOH溶液作电解质溶液,由反应②设计的燃料电池,工作一段时间后,KOH溶液的pH将增大 |
C
解析试题分析:已知N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ·mol-1,该反应为吸热反应,反应后能量升高,所以反应物所具有的总能量小于生成物所具有的总能量,故A错误;根据热化学方程式①②,再根据目标方程式为2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),可以通过2×②-①得到即2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),△H=2×②-①=2×(-534kJ·mol-1)-(+67.7kJ·mol-1)=-1135.7kJ·mol-1,所以2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g),△H=-1135.7kJ·mol-1,故B错误;负极是N2H4失电子生成N2和H2O,则其电极反应式为:N2H4-4e-+4OH-=N2+4H2O,故C正确;已知该电池反应的总方程为:N2H4+O2=N2+2H2O,反应生成水,溶液的体积增大,所以氢氧化钾的浓度减小,即溶液的pH减小,故D错误。
考点:考查反应中能量变化,热化学方程式的书写方法和盖斯定律的计算应用等。


科目:高中化学 来源: 题型:单选题
100 g炭粉燃烧所得气体中,CO占 、CO2占
、CO2占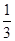 ,且C(s)+
,且C(s)+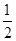 O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH=-110.35 kJ·mol-1,CO(g)+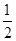 O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
O2(g)=CO2(g) ΔH=-282.57 kJ·mol-1,与这些炭粉完全燃烧相比损失的热量是 ( )。
| A.784.92 kJ | B.2 489.44 kJ | C.1 569.83 kJ | D.3 274.3 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
中和热的数值是57.3kJ/mol。下列酸、碱溶液混合产生的热量等于57.3kJ的是( )
| A.1mol/L的稀HCl溶液与1mol/L的稀NaOH溶液 |
| B.1mol/L的稀H2SO4溶液与1mol/L的稀Ba(OH)2溶液 |
| C.1 L 1mol/L的稀HCl溶液与2 L 1mol/L的稀NaOH溶液 |
| D.1 L 1mol/L的稀H2SO4溶液与1 L 1mol/L的稀Ba(OH)2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)  CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )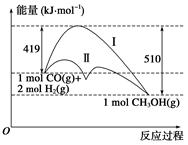
| A.该反应的ΔH=+91 kJ·mol-1 |
| B.加入催化剂,该反应的ΔH变小 |
| C.反应物的总能量大于生成物的总能量 |
| D.如果该反应生成液态CH3OH,则ΔH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列物质间的反应,其能量变化符合如图的是( )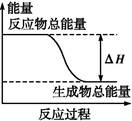
| A.铁与硫粉在加热条件下的反应 |
| B.灼热的碳与二氧化碳反应 |
| C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合 |
| D.碳酸钙的分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法不正确的是( )
| A.反应是放热还是吸热必须看生成物和反应物所具有的总能量的相对大小 |
| B.绿色植物进行光合作用时,将太阳能转化为化学能储存起来 |
| C.吸热反应中由于反应物总能量小于生成物总能量,因而无利用价值 |
| D.物质的化学能可以在一定条件下转化为热能、电能为人类所利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知①2C(s)+O2(g) 2CO(g) ΔH="-221.0" kJ·mol-1
2CO(g) ΔH="-221.0" kJ·mol-1
②2H2(g)+O2(g) 2H2O(g) ΔH="-483.6" kJ·mol-1
2H2O(g) ΔH="-483.6" kJ·mol-1
则反应C(s)+H2O(g) CO(g)+H2(g)的ΔH为( )
CO(g)+H2(g)的ΔH为( )
| A.+131.3 kJ·mol-1 | B.-131.3 kJ·mol-1 | C.-352.3 kJ·mol-1 | D.+262.6 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知:2SO2(g)+O2(g) 2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
2SO3(g)ΔH="-197" kJ·mol-1。实验测得4 mol SO2参加上述反应放出354 kJ热量,则SO2的转化率最接近于( )
| A.90% | B.80% | C.50% | D.40% |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.任何酸与碱发生中和反应生成1 mol H2O的过程中,能量变化均相同 |
| B.同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| C.已知:①2H2(g)+O2(g)=2H2O(g)ΔH=-a kJ·mol-1, ②2H2(g)+O2(g)=2H2O(l)ΔH=-b kJ·mol-1,则a>b |
| D.已知:①C(s,石墨)+O2(g)=CO2(g)ΔH=-393.5 kJ·mol-1, |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com