
【题目】请按要求填空:
(1)C、N元素形成的新材料具有如图所示的结构该晶体的化学式为________________。
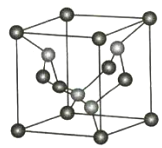
![]() C(位于顶点和面心)
C(位于顶点和面心)![]() N
N
(2)氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定。
①氮化硅的硬度________(填“大于”或“小于”)氮化碳的硬度,原因是___________________________。
②已知氮化硅的晶体结构中,原子间都以单键相连,且氮原子与氮原子不直接相连、硅原子与硅原子不直接相连,同时每个原子都满足最外层8电子稳定结构,请写出氮化硅的化学式:______________。
(3)第ⅢA、VA元素组成的化合物GaN、GaP、CaAs等是人工合成的新型半导体材料,其晶体结构与晶体硅相似。在GaN晶体中,每个Ga原子与________个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为________。在四大晶体类型中,GaN属于________晶体。
【答案】C3N4 小于 硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,故氮碳形成的共价键的键能大 Si3N4 4 正四面体形 原子
【解析】
(1)根据晶胞结构计算化学式,角上原子计![]() ,棱上原子计
,棱上原子计![]() ,面上原子计
,面上原子计![]() ,内部原子计1;
,内部原子计1;
(2)①原子晶体键长越短,键能越大,晶体硬度越大;②根据最外层8电子稳定结构,写出氮化硅的化学式;
(3)GaN晶体与晶体硅结构相似,为原子晶体,空间构型为正四面体结构。
(1)根据晶胞的结构可知含有碳原子数目![]() ,氮原子数目为4,则化学式为:C3N4,故答案为:C3N4;
,氮原子数目为4,则化学式为:C3N4,故答案为:C3N4;
(2)①氮化碳和氮化硅晶体结构相似,是新型的非金属高温陶瓷材料,它们的硬度大、熔点高、化学性质稳定,这说明二者形成的晶体都是原子晶体,由于硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,键能大,所以氮化硅的硬度小于氮化碳的硬度,故答案为:小于;硅原子半径大于碳原子半径,氮碳形成的共价键键长比氮硅形成的共价键键长短,故氮碳形成的共价键的键能大;
②N的最外层电子数为5,要满足8电子稳定结构,需要形成3个共价键,Si的最外层电子数为4,要满足8电子稳定结构,需要形成4个共价键,所以氮化硅的化学式为:Si3N4,故答案为:Si3N4;
(3)GaN的晶体结构与晶体硅相似,则GaN属于原子晶体,每个Ga原子与4个N原子相连,与同一个Ga原子相连的N原子构成的空间构型为正四面体形,故答案为:4;正四面体形;原子。


科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A元素原子最外层p能级的电子数等于次外层的电子总数,C元素原子最外层中有2个未成对电子。已知C、D、E元素原子核内的质子数均与中子数相等,且C元素可分别与A、B、D、E生成![]() 型化合物,在
型化合物,在![]() 中,D与C的质量比为7:8,在
中,D与C的质量比为7:8,在![]() 中,E与C的质量比为1:1。
中,E与C的质量比为1:1。
请回答下列问题:
(1)写出A、E两种元素的元素符号:A ____________ 、E ____________ 。
(2)写出D元素原子的核外电子排布式: ____________ 。
(3)指出E在元素周期表中的位置: ____________ 。
(4)比较A、B、C三种元素的第一电离能的大小: ____________ (填元素符号,下同)。
(5)比较D元素和E元素的电负性的相对大小: ____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.熔融状态下硫酸氢钾中的离子键、共价键均被破坏,形成定向移动的离子,因而能够导电
B.F2、Cl2、Br2、I2的熔沸点逐渐升高,是因为分子间作用力越来越大
C.NH3和Cl2两种分子中,每个原子的最外层都达到8电子的稳定结构
D.HF、HCl、HBr、HI的稳定性逐渐减弱,沸点逐渐升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示转化关系中A、B、C均为双原子气态单质,分别由短周期主族元素X、Y、Z组成。其中单质B含共用电子对数最多,甲和丙分子中均含有10个电子。下列说法错误的是( )
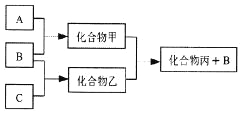
A. Z元素位于第二周期第VIA族
B. 可用排水法收集化合物乙
C. 元素X、Y、Z的原子半径大小关系为X<Z<Y
D. 化合物甲溶于化合物丙中,存在的微粒有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、Q为原子序数依次增大的前四周期元素,X的核外有2个未成对电子,与题述其他元素均能形成二元化合物;Y是地壳中含量最多的金属元素;Z的第一电离能比同周期相邻两种元素的都大;W的外层电子数是最内层电子数的9倍;Q的某种核素的质量数为56,中子数为30。据此回答下列问题:
(1)Q的基态原子的价电子排布式为______________。
(2)题述元素中,电负性最大的是______________(填元素符号),第一电离能介于Y和Z之间的同周期元素有______________(填元素符号)。
(3)Y和W的氯化物中熔点较高的是________(填化学式),原因是_____;与Z的低价氯化物互为等电子体的离子是_______(填一种即可)。
(4)咖啡因对中枢神经有兴奋作用,其结构简式如图所示。常温下,咖啡因在水中的溶解度很小,加适量水杨酸钠[C6H4(OH)(COONa)]可使其溶解度增大,其原因可能是_________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学和生活、社会发展息息相关,从古代文物的修复到现在的人工智能,我们时时刻刻能感受到化学的魅力。下列说法不正确的是
A. 银器发黑重新变亮涉及了化学变化
银器发黑重新变亮涉及了化学变化
B. 煤综合利用时采用了干馏和液化等化学方法
煤综合利用时采用了干馏和液化等化学方法
C. 瓷器主要成分属于硅酸盐
瓷器主要成分属于硅酸盐
D. 芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
芯片制造中的“光刻技术”是利用光敏树脂在曝光条件下成像,该过程并不涉及化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水四氯化锡(SnC14)是一种用途广泛的化工中间体,常用作媒染剂和有机合成的氯化催化剂。熔融的金属锡(熔点231℃)在300℃左右能直接与Cl2作用生成无水四氯化锡,实验室装置如图所示:

已知信息如下:①将金属锡熔融,通人干燥氯气进行反应,生成四氯化锡。②无水四氯化锡是无色易流动的液体,熔点为一33℃,沸点为114.1℃。二氯化锡是无色晶体,熔点为246℃,沸点为652℃。③无水四氯化锡在空气中极易水解,水解产物之一是SnO2.xH2O,并产生白烟。请回答下列问题:
(l)开始实验前一定要____,E中冷水的作用是 ___。
(2)装置F中盛放的最佳试剂为 ___,作用是____。
(3)实验时应先打开A处分液漏斗旋塞和整套装置的阀门,待观察到____这一现象时,再点燃D处酒精灯。
(4)若撤去装置C,则D中还可能发生反应的化学方程式为 __。
(5) Cl2和锡作用即可生成SnC14,也会生成SnCl2,为减少SnCl2的生成,可采取的措施是 _______ .
(6)得到的产物中常含有杂质SnCl2,SnCl2是常用的还原剂。某实验小组用碘氧化法滴定分析产品中杂质SnCl2的质量分数。准确称取a克该样品于锥形瓶,用适量浓盐酸溶解,淀粉溶液作指示剂,c mol.L-l碘标准溶液滴定至终点,消耗标准液20. 00mL,已知滴定原理是:SnCl2+2HCl+I2=SnC14+2HI,则产品中杂质SnCl2的质量分数为____(用含a、c的代数式表示);即使此法测定的操作均正确,但测得的SnCl2含量仍低于实际含量,其原因可能是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“点击化学”是指快速、高效连接分子的一类反应,例如铜催化的Huisgen环加成反应:

我国科研人员利用该反应设计、合成了具有特殊结构的聚合物F并研究其水解反应。合成线路如下图所示:
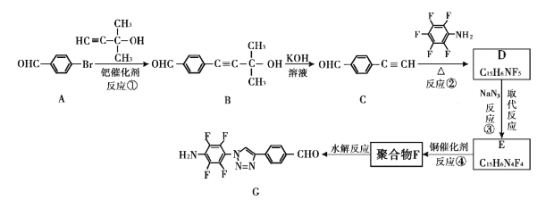
已知:![]()
(1)A生成B的反应类型是____。
(2)关于B和C,下列说法正确的是____(填字母序号)。
a 利用核磁共振氢谱可以鉴别B和C b B不能发生消去反应 c 可用酸性高锰酸钾溶液检验C中含醛基
(3)B生成C的过程中还有另一种生成物X,分子式为C3H6O,核磁共振氢谱显示只有一组峰,X的结构简式为 ___。
(4)反应②的化学方程式为 ___。
(5)请根据以上流程,并推测聚合物F所具有的特殊结构,下列关于聚合物F的结构说法正确的是___
A F中必含 -CH2=N- 结构
B F中必含 -N=N- 结构
C F的结构可能是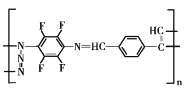
(6)H是比A多一个碳原子的同系物。H的同分异构体中符合下列条件的有 ___种。
①苯环上有三个取代基 ②能和FeCl3发生显色反应
(7)为了探究连接基团对聚合反应的影响,设计了单体K,其合成路线如下,写出H、I、J的结构简式:___
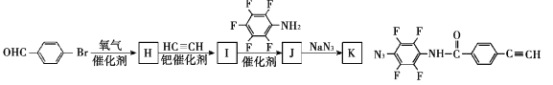
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】L多巴胺是一种有机物,它可用于帕金森综合症的治疗,其结构简式如下
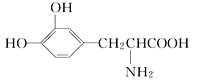
下列关于L多巴胺的叙述不正确的是( )
A. 它属于α氨基酸,既具有酸性,又具有碱性
B. 它遇到FeCl3溶液显紫色
C. 它可以两分子间缩合形成分子式为C18H18O6N2的化合物,该化合物中有3个六元环
D. 它既与酸反应又与碱反应,等物质的量的L多巴胺最多消耗NaOH与HCl的物质的量之比为1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com