
����Ŀ������ý����Ҫ�Ĵ�����CO��������ý���õ�����ʧȥ�����ԣ�Fe+5CO=Fe��CO��5����ȥCO�Ļ�ѧ��Ӧ����ʽΪ��
[Cu��NH3��2]OOCCH3+CO+NH3=[Cu��NH3��3��CO��]OOCCH3 ��
��ش��������⣺
��1��C��N��O�ĵ縺���ɴ�С��˳��Ϊ �� ��̬Feԭ�ӵļ۵����Ų�ͼΪ ��
��2��Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬��Fe��CO��5�ľ��������� �� ��CO��Ϊ�ȵ�����ķ��ӵĵ���ʽΪ ��
��3�������[Cu��NH3��2]OOCCH3��̼ԭ�ӵ��ӻ������� �� �������ṩ�¶Ե��ӵ�ԭ���� ��
��4����[Cu��NH3��2]OOCCH3��ȥCO�ķ�Ӧ�У��϶����γɣ�
a�����Ӽ� b����λ�� c���Ǽ��Լ� d���ļ�
��5��NaAlH4����ľ�����ͼ��
��Na+�����ҵȾ��AlH4��������NaAlH4������ܶ�Ϊgcm��3���ú�a�Ĵ���ʽ��ʾ����
���𰸡�
��1��O��N��C��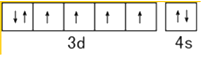
��2�����Ӿ��壻![]()
��3��sp3��sp2��N
��4��bd
��5��8��![]()
���������⣺��1��ͬһ����Ԫ�أ�Ԫ�ص縺������ԭ���������������������Ԫ�ص�һ�����ܴ�С˳����O��N��C��Feԭ��3d��4s�ܼ�����Ϊ��۵��ӣ���̬Feԭ�ӵļ۵����Ų�ͼΪ 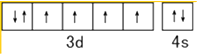 �����Դ��ǣ�O��N��C��
�����Դ��ǣ�O��N��C�� 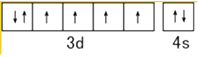 ����2���۷е�ϵ͵ľ���Ϊ���Ӿ��壬Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬���۷е�ϵͣ�Ϊ���Ӿ��壻��CO��Ϊ�ȵ�����ķ����ǵ������ӣ�����ʽΪ
����2���۷е�ϵ͵ľ���Ϊ���Ӿ��壬Fe��CO��5�����ʻ�����������Ϊ��ɫ��״Һ�壬���۷е�ϵͣ�Ϊ���Ӿ��壻��CO��Ϊ�ȵ�����ķ����ǵ������ӣ�����ʽΪ ![]() ��
��
���Դ��ǣ����Ӿ��壻 ![]() ����3�����������Cԭ�Ӽ۲���ӶԸ�����4��3�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ�������ȷ��Cԭ���ӻ���ʽΪsp3��sp2 �� ��������Cuԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷԣ�
����3�����������Cԭ�Ӽ۲���ӶԸ�����4��3�Ҳ����µ��Ӷԣ����ݼ۲���ӶԻ�������ȷ��Cԭ���ӻ���ʽΪsp3��sp2 �� ��������Cuԭ���ṩ�չ����Nԭ���ṩ�µ��Ӷԣ�
���Դ��ǣ�sp3��sp2��N����4����[Cu��NH3��2]OOCCH3��ȥCO�ķ�Ӧ�У��϶���Cuԭ�Ӻ�N��Cԭ��֮�����λ����Ҳ�Ǧļ����ɣ�
��ѡbd����5�����ݾ�̯����֪��������AlH4����ĿΪ1+8�� ![]() +4��
+4�� ![]() =4��Na+��ĿΪ6��
=4��Na+��ĿΪ6�� ![]() +4��
+4�� ![]() =4���������λ��Ϊ1��1�������ĵ�AlH4���о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4�������ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4����8����
=4���������λ��Ϊ1��1�������ĵ�AlH4���о�����֮�����ҵȾ��Na+λ�ھ�����֮�䡢�������������������Ҳ������ġ�����������������ǰ��������ģ���AlH4�������ҵȾ��Na+��8��������Na+�����ҵȾ��AlH4����8����
��������Ϊ4�� ![]() g�������ܶ�Ϊ4��
g�������ܶ�Ϊ4�� ![]() g��[��a��10��7 cm��2��2a��10��7 cm]=
g��[��a��10��7 cm��2��2a��10��7 cm]= ![]() gcm��3 ��
gcm��3 ��
���Դ��ǣ�8�� ![]() ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�ӦmA��g��+nB��g��pC��g�����ﵽƽ��������¶�ʱ��B��ת���ʼ�С������Сѹǿʱ�������ϵ��A����������������
��1���÷�Ӧ������Ӧ���ȷ�Ӧ����m+np �����������������=������
��2������ѹǿʱ��B��ת���������������С�����䡱����ͬ�����淴Ӧ���� ��
��3��������C��������䣩����A��������� ��
��4���������¶ȣ���ƽ��ʱB��C��Ũ��֮�� ![]() ��ֵ�� ��
��ֵ�� ��
��5��������������÷�Ӧ�ķ�Ӧ�� ��
��6����B����ɫ���ʣ�A��C��Ϊ��ɫ���ʣ�ά������������䣬��������ʱ������������ɫ�����dz������������䡱����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ԫ�� R ��ij��ͬλ�ص��Ȼ��� RClX�����Ȼ����� R ������������Ϊ Y�����������Ϊ Z����ͬλ�صķ���Ϊ
A. YZRB. Y+X+ZX+ZRC. YZ+XRD. Y+XZR
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ũ������к�ǿ�ĸ�ʴ�ԣ���ѧʵ��ʱһ��Ҫ�ر�ע�ⰲȫ���������������Ũ����մ��Ƥ���ϣ�����Ѹ���ô�����ˮ��ϴ��Ȼ����Ϳ�ϣ� ��
A.3%��5%��̼��������ҺB.2%��5%��������Һ
C.5%��10%������������ҺD.5%��10%��ϡ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͬѧ������FeCl2��Һ�����ơ�Ũ�ȵIJⶨ�Լ�Fe2+��ԭ�Ե�ʵ�飬������쳣�������̽����
��1������һ����ȡFeCl2 ��ͬѧ�������ַ�����ȡ��
����1������ͼװ����H2��ԭ��ˮFeCl3��ȡ��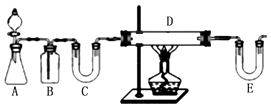
E��ʢ�ŵ��Լ�����D�з�Ӧ�Ļ�ѧ����ʽΪ �� �˷����и����Ե�ȱ���� ��
����2����0.1molL��1 FeCl3��Һ��ȡFeCl2��Һ������Ϊ�����Ӧ���� ��
��2����������ⶨ����2����FeCl2��Һ�����ʵ���Ũ�ȣ����ظ���ط���һ��������ԭ�ζ������ɴﵽĿ�ģ���������Ũ��Ϊ0.01000molL��1��K2Cr2O7����Һ480mL��ʵ�����õ��IJ�����������Ͳ�����������ձ�����ȱ�� ��
��ʵ��ζ������в����ζ��ܵ�ͼʾ��ȷ���������ţ���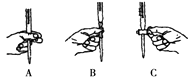
���д���IJ���ʹ�ⶨ��FeCl2��ҺŨ��ƫС����
A����������K2Cr2O7����Һ����ʱ��ȡ��������
B�����ζ������У�����ζ�ǰװ��K2Cr2O7����Һ�ĵζ��ܼ��첿�������ݣ����ζ�������������ʧ��
C����ƿϴ����δ����
��3������������2mL FeCl2��Һ�еμ�2��0.1molL��1KSCN��Һ���������ٵμ�5��5% H2O2��Һ�����ʵ���Ũ��ԼΪ1.5molL��1��pHԼΪ5�����۲쵽��Һ��죬��Լ10�����Һ�ɫ��ȥ�����������ɣ�������ΪO2����
��ͬѧ̽����������������Һ��ɫ��ԭ��
ʵ��I��ȡ��ɫ����Һ���ݣ�һ�ݵμ�FeCl3��Һ��������һ�ݵμ�KSCN��Һ���ֺ�ɫ��
ʵ��II��ȡ��ɫ����Һ���μ������BaCl2��Һ��������ɫ��������������������ֿ�ֱ���ŷŵ������е����壮
ʵ��III����2mL 0.1molL��1 FeCl3��Һ�еμ�2��0.1molL��1KSCN��Һ����죬ͨ��O2 �� �����Ա仯��
��ʵ��I˵����Һ��ɫ��ȥ����ΪSCN�������˷�Ӧ������Fe3+������Ӧ��
��ʵ��III��Ŀ���� ��
�ó����ۣ���Һ��ɫ��ԭ��������������H2O2��SCN��������SO42����������壮д���÷�Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������һ�ָ����մɲ��ϣ���Ӳ�ȴ��۵�ߣ���ѧ�����ȶ�����ҵ���ձ���øߴ����봿����1300�淴Ӧ��á�
��1���������ʣ��Ʋ�����մɵ���;����(�����)
a�������ֻ�b������ɫ����
c����������ģ��d��������ͻ�
��2��д��N��ԭ�ӽṹʾ��ͼ �� ����Ԫ��������֪ʶ����д��������Ļ�ѧʽ��
��3���������մɿ���ʴ����ǿ����������⣬�������������ᷴӦ�����Ʋ���մɱ�����ḯʴ�Ļ�ѧ����ʽ��
��4���������Ȼ����뵪�����������ձ����£���ǿ�ȷ�����Ӧ���ɵýϸߴ��ȵĵ����裬��Ӧ�Ļ�ѧ����ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������о綾��������������������ࡢ������֯���������������Ͻ���ʳ�����ķ���ʽΪC10H15N�����еĵ�Ԫ�������ڱ��д���
A. ��IIA�� B. ��IIIA�� C. ��IVA�� D. ��VA��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ʯ�͡�ú����Ȼ���Ȼ�ʯ��Դ��˵����ȷ���ǣ� ��
A.ʯ�Ͳ�Ʒ����ֱ�����ͺ��ѻ����͵ijɷ���ͬ
B.���������ʯ��Դ�Ĺ��̾�Ϊ��ѧ�仯
C.ˮú����ͨ��ú��Һ���õ�������ȼ��
D.��Ȼ����һ�������Դ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��M��һ�����Ϳ����オ��ĸ߷��Ӳ��ϣ���Ҫ����ɽ�����ά�����Ϻ�ҽ�ò��ϣ���ˮ�����ղ���ΪN��ȼ��9.0g��Nֻ����CO2��H2O���������ֱ�Ϊ13.2g��5.4g��ʵ����N�ڱ�״���µ������ܶ�Ϊ4.02g/L��N�ĺ˴Ź���������ʾ�ķ����֮��Ϊ1��1��1��3��
��1��ͨ������ȷ��N�ķ���ʽ
��2��д����N�ڴ������������۷�Ӧ�ϳ�M�Ļ�ѧ����ʽ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com