
| A. | 乙醇 | B. | 乙酸 | C. | 乙酸乙酯 | D. | 戊烷 |
分析 乙醇存在两种同分异构体;乙酸存在乙酸、甲酸甲酯和OHCH2CHO 共3种结构;乙酸乙酯存在碳链异构、官能团异构、位置异构等多种同分异构体;戊烷存正戊烷、异戊烷和新戊烷3种同分异构体,据此进行解答.
解答 解:A.乙醇存在2种同分异构体:乙醇和二甲醚;
B.乙酸的同分异构体有:乙酸、甲酸甲酯和OHCH2CHO,总共存在3种同分异构体;
C.乙酸乙酯分子式为C4H8O2,属于酯类的异构体有4种:若为甲酸和丙醇酯化,甲酸1种,丙醇有2种;若为乙酸和乙醇酯化,乙酸1种,乙醇有1种;若为丙酸和甲醇酯化,丙酸有1种,甲醇1种,还有属于羧酸的异构体等,所以乙酸乙酯含有的同分异构体数目大于4,
D.戊烷的3种同分异构体:CH3CH2CH2CH2CH3、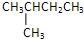 、
、 ;
;
根据分析可知,同分异构体数目最少的为A,
故选A.
点评 本题主要考查了同分异构体数目的判断,题目难度不大,可通过同分异构体的类型进行简单判断,注意熟练掌握同分异构体的概念甲基书写原则.


科目:高中化学 来源: 题型:选择题
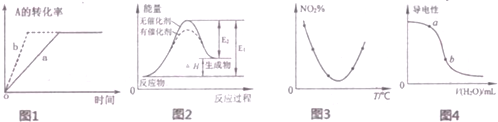
| A. | 图1所示反应:A(g)+2B(g)?3C(g),b曲线表示的一定是增大压强 | |
| B. | 图2表示催化剂能改变化学反应的焓变 | |
| C. | 图3表示等量N02在容积相同的恒容密闭容器中,不同温度下分别发生反应;2NO2(g)?N2O4(g),相同时间后测得NO2含量的曲线,则该反应的△H<0 | |
| D. | 图4表示向稀CH3COOH溶液中加水时溶液的导电性变化,则CH3COOH溶液的pH:a>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CuSO4溶液将ZnS转化成CuS沉淀:S2-+Cu2+═CuS↓ | |
| B. | NH4HCO3溶液与过量NaOH溶液混合加热:NH${\;}_{4}^{+}$+OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| C. | 向酸化的FeSO4溶液中滴入少量H2O2溶液:H2O2+2Fe2++2H+═2Fe3++2H2O | |
| D. | 用惰性电极电解饱和的KCl溶液:2H++2Cl$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
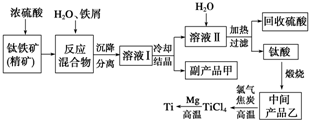 金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.
金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 |
| A. | X、Y元素的金属性X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z单质在放电条件下发生化合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y元素可显+6价 | |
| B. | X、Y、Z三种元素组成的化合物化学式可能是X2YZ3、X2YZ4等 | |
| C. | X、Y、Z三种元素组成的化合物不一定呈中性 | |
| D. | Y的电负性比Z大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com