
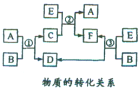
 A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.
A、B、C、D、E、F六种物质在一定条件下有如图所示的转化关系,所有反应物和生成物均已给出.| E的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(F的阴离子)/mol | 1.25 | 1.5 | 2 |
| n(C中的阴离子)/mol | 1.5 | 1.4 | y |
| n(B中的阴离子)/mol | x | 0 | 0 |
分析 (1)反应①②③均为水溶液中的置换反应,A、D、E为卤素单质,由转化关系可知,氧化性应有E>A>D,化合物中的阳离了均为Na+,则A为Br2,D为I2,E为Cl2,B为NaI、C为NaBr、F为NaCl;
在一定条件下E(Cl2)和D(I2)以物质的量比为5:l在硫酸溶液中恰好完全反应,据得失电子守恒有5Cl2+I2--10Cl-+2IO3-,再据电荷守恒有5Cl2+I2--10Cl-+2IO3-+12H+,最后据原子守恒配平;
(2)I.F的阴离子为Cl-,C的阴离子为Br-,B的阴离子为I-,E为Cl2,还原性I->Br-,氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,发生Cl2+2Br-═2Cl-+Br2时消耗Br-为0.25mol<1.5mol-1.4mol=0.1mol,则通入2.8L→5.6L时依次发生的离子反应为:Cl2+2I-=2Cl-+I2、Cl2+2Br-═2Cl-+Br2;
Ⅱ.由I中分析可知,通入2.8L→5.6L氯气氧化Br-为0.1mol,根据电子转移守恒计算I-的物质的量;
5.6L→11.2L时通入氯气5.6L,其物质的量为0.25mol,溶液中Cl-离子增大2mol-1.5mol=0.5mol,说明氯气完全反应,根据Cl2+2Br-═2Cl-+Br2计算5.6L→11.2L时消耗Br-离子的物质的量,进而计算y的值;
Ⅲ.根据电荷守恒可知:溶液中c(Na+)=c(Cl-)+c(Br-).
解答 解:(1)反应①②③均为水溶液中的置换反应,A、D、E为卤素单质,由转化关系可知,氧化性应有E>A>D,化合物中的阳离了均为Na+,则A为Br2,D为I2,E为Cl2,B为NaI、C为NaBr、F为NaCl,三者的氧化性由弱到强的顺序为I2<Br2<Cl2;
在一定条件下E(Cl2)和D(I2)以物质的量比为5:l在硫酸溶液中恰好完全反应,据得失电子守恒有5Cl2+I2--10Cl-+2IO3-,再据电荷守恒有5Cl2+I2--10Cl-+2IO3-+12H+,最后据原子守恒得:5Cl2+I2+6H2O=10Cl-+2IO3-+12H+,
故答案为:I2<Br2<Cl2;5Cl2+I2+6H2O=10Cl-+2IO3-+12H+;
②Ⅰ.F的阴离子为Cl-,C的阴离子为Br-,B的阴离子为I-,E为Cl2,还原性I->Br-,氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,发生Cl2+2Br-═2Cl-+Br2时消耗Br-为0.25mol<1.5mol-1.4mol=0.1mol,则通入2.8L→5.6L氯气时依次发生的离子反应为:Cl2+2I-=2Cl-+I2、Cl2+2Br-═2Cl-+Br2,
故答案为:Cl2+2I-=2Cl-+I2;
Ⅱ.由I中分析可知,通入2.8L→5.6L氯气氧化Br-为0.1mol,氯气的物质的量为$\frac{2.8L}{22.4L/mol}$=0.125mol,根据电子转移守恒,氧化I-的物质的量=0.125mol×2-0.1mol=0.15mol;
5.6L→11.2L时通入氯气5.6L,其物质的量为$\frac{5.6L}{22.4L/mol}$=0.25mol,溶液中Cl-离子增大2mol-1.5mol=0.5mol,说明氯气完全反应,根据Cl2+2Br-═2Cl-+Br2可知,算5.6L→11.2L时消耗Br-离子的物质的量为0.25mol×2=0.5mol,则剩余Br-离子的物质的量1.4mol-0.5mol=0.9mol,
故答案为:0.15;0.9;
Ⅲ.当通入E的体积为11.2L时,溶液中Cl-物质的量为2mol,Br-为0.9mol,依据电荷守恒,溶液体积为1L,该溶液中c(Na+)=c(Cl-)+c(Br-)=2.9mol/L;
故答案为:2.9.
点评 本题考查无机物推断、混合物计算、氧化还原反应等,侧重考查学生分析推理与计算能力,题目难度中等.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| c(X)/mol•L-1 | 0.2 | c | 0.6 | 0.6 | 1.0 | c1 | c1 |
| c(YX)/mol•L-1 | 0.6 | c | 0.4 | 0.4 | 0.4 | c2 | c2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| B. | 常温常压下,7.8克苯中含0.3NA个碳碳双键 | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5 NA | |
| D. | 50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
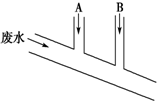 某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )
某化工厂排出的废水中含Cl2 0.014mol•L-1、H+ 0.001mol•L-1,废水排出的速度为10.0mL•s-1.为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的烧碱溶液(0.10mol•L-1)和Na2SO3溶液(0.10mol•L-1).下列说法错误的是( )| A. | 排出管A处发生的反应为SO32-+Cl2+H2O═SO42-+2Cl-+2H+ | |
| B. | 废水排出管B处发生的反应为H++OH-═H2O | |
| C. | A处溶液的流量为1.4 mL•s-1 | |
| D. | B处溶液的流量为2.8 mL•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
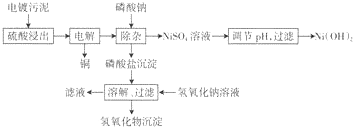
| 金属离子 | Cu3+ | Ni3+ | Fe3+ | Al3+ | Cr3+ |
| 浓度(mg/L) | 7000 | 7000 | 2500 | 4200 | 3500 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
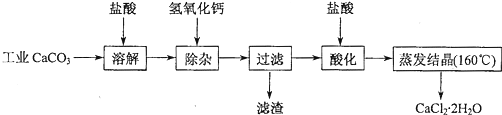
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com