
| A. | Ba(OH)2与H2S04 | B. | FeBr2与Cl2 | C. | HCI与Na2CO3 | D. | NaHC03与Ca(OH)2 |
分析 A.硫酸与氢氧化钡反应生成硫酸钡沉淀和水,与反应物的量多少无关;
B.亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应,氯气过量时亚铁离子和溴离子都参与反应;
C.盐酸过量时生成二氧化碳气体,盐酸不足时生成碳酸氢钠;
D.氢氧化钙过量时生成碳酸钙、氢氧化钠,氢氧化钙不足时生成碳酸钙、碳酸钠.
解答 解:A.氢氧化钡与硫酸反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,与反应物是否过量无关,故A正确;
B.FeBr2与Cl2,氯气不足时,只有亚铁离子反应,氯气过量时,亚铁离子和溴离子都反应,所以氯气是否过量影响离子方程式,故B错误;
C.HCl与Na2CO3的反应中,HCl过量时,反应生成二氧化碳气体,HCl不足时生成NaHCO3,反应物的过量情况影响离子方程式,故C错误;
D.NaHCO3与Ca(OH)2反应中,氢氧化钙过量时生成碳酸钙和氢氧化钠,氢氧化钙不足时,反应生成碳酸钙和碳酸钠,反应物过量与不足影响反应产物,故D错误;
故选A.
点评 本题考查了离子方程式的书写,侧重考查反应物过量与不足对生成物的影响,题目难度不大,明确离子方程式的书写原则为解答关键,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:解答题
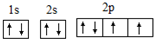 ;氧元素原子核外有3种不同能级的电子;
;氧元素原子核外有3种不同能级的电子;查看答案和解析>>
科目:高中化学 来源: 题型:
 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠保存在煤油中 | |
| B. | 烧碱溶液盛装在带有玻璃塞的试剂瓶中 | |
| C. | 含有Fe3+的盐溶液遇KSCN 溶液变红 | |
| D. | 明矾(KAl(SO4)2•12H2O)可用作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某无色透明的酸性溶液:Cl-、Na+、MnO4-、SO42- | |
| B. | 能使pH试纸变深蓝色的溶液:Na+、NH4+、K+、CO32- | |
| C. | 加入过量NaOH溶液后可得到澄清的溶液:K+、Ba2+、HCO3-、Cl- | |
| D. | 常温下pH=12的溶液:K+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
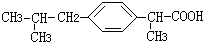
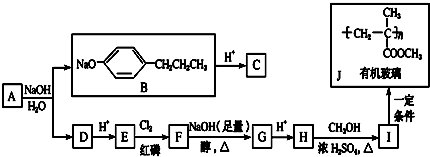
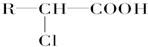 +HCl
+HCl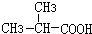 、G
、G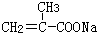 .
.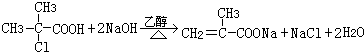 ;H→I
;H→I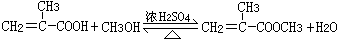 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
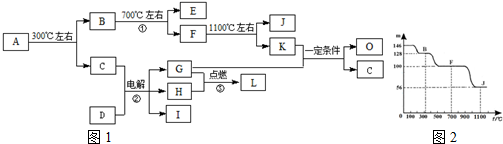
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | CO2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| C | C2H4(SO2) | 酸性高锰酸钾 | 洗气 |
| D | CH3CH2OH(H2O) | 生石灰 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com