
分析 (1)反应消耗Cu的质量为:20g-7.2g=12.8g,根据反应Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O计算出生成二氧化硫气体的体积;
(2)铜离子全部沉淀时,反应后溶质为硫酸钠,根据S、Na元素守恒计算出需要氢氧化钠的物质的量,然后根据V=$\frac{n}{c}$计算出需要加入氢氧化钠溶液的体积.
解答 解:(1)反应消耗Cu的质量为:20g-7.2g=12.8g,则
Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O
64g 22.4L
12.8g V(SO2)
V(SO2)=$\frac{22.4L×12.8g}{64g}$=4.48L,
答:标准状况下,产生气体的体积为4.48L;
(2)标况下4.48L二氧化硫的物质的量为:$\frac{4.48L}{22.4L/mol}$=0.2mol,100mL18mol•L-1浓硫酸中含有硫酸的物质的量为:18g/mol×0.1L=1.8mol,反应后溶液中含有硫酸根离子的物质的量为:1.8mol-0.2mol=1.6mol,
使溶液中的Cu2+全部沉淀时,反应后溶质为Na2SO4,根据Na元素守恒可知消耗NaOH的物质的量为:n(NaOH)=2n(Na2SO4)=1.6mol×2=3.2mol,
需加入该氢氧化钠溶液的体积为:$\frac{3.2mol}{2mol/L}$=1.6L,
故答案为:1.6.
点评 本题考查了化学方程式的计算,题目难度中等,明确发生反应的实质为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | 上述转化属于分解反应 | B. | 上述反应过程放出大量热 | ||
| C. | 生成的CaO可作氯气的干燥剂 | D. | CaCO3水泥的主要成分之一. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
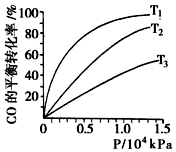 汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、
汽车尾气作为空气污染的主要来源之一,含有大量的有害物质,包括CO、| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH(g) | CH3OCH3(g) | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/LFeCl3溶液中:Fe2+、NH4+、SCN-、SO42- | |
| B. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO42- | |
| C. | 加入铝粉有气泡产生的溶液中:Na+、NH4+、Fe2+、NO3- | |
| D. | 饱和氯水中:K+、Na+、Cl-、HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用分液漏斗分离水和四氯化碳的混合物时,四氯化碳从上口倒出 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快过滤速度 | |
| C. | 可以用酒精萃取碘水中的碘 | |
| D. | 海水通过蒸馏可制得淡水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com