
分析 (1)CO与NO反应,生成无毒气体为氮气和二氧化碳;
(2)根据催化剂不能使本来不能发生的反应发生来分析;
(3)催化剂只能加快反应速率;
(4)根据汽车尾气的成分来分析.
解答 解:(1)由信息可知,“催化转换器”使CO与NO反应,生成无毒气体为氮气和二氧化碳,该反应为2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2,
故答案为:2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2;
(2)催化剂不能使本来不能发生的反应发生,故既然反应2CO+2NO$\frac{\underline{\;催化剂\;}}{\;}$N2+2CO2在有催化剂的条件下能发生,则说明无催化剂也能发生,只是反应速率较慢而已,故答案为:能;
(3)催化剂不能使本来不能发生的反应发生,只能加快反应速率,故答案为:加快反应速率;
(4)汽车尾气中含CO、碳氢化合物、NOx等有害气体,会对空气造成污染,且NOx能导致光化学烟雾,故答案为:①汽车尾气中含有CO、碳氢化合物、NOx等有害气体,是现代大城市的重要污染源之一;②汽车尾气可能会导致光化学烟雾.
点评 本题考查了汽车尾气的污染以及治理,应注意的是催化剂不能使本来不能发生的反应发生,只能加快反应速率.


科目:高中化学 来源: 题型:选择题
| R | X | |||
| W | Y | Z |
| A. | W的氧化物属于酸性氧化物,与一切酸都不能发生反应 | |
| B. | Z的单质可用于杀灭田鼠 | |
| C. | Y、Z的最高价氧化物对应的水化物的酸性:Y>Z | |
| D. | X、Y的氢化物的沸点:Y>X |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:
已知V、W、X、Y、Z是原子序数一次增大的短周期主族元素,V、Y在周期表中的相对位置如表所示,V元素与氧元素能形成两种无色气体,X是地壳中含量罪所的金属元素,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
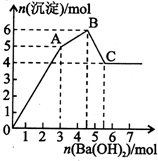 向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )
向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示.沉淀的生成与溶解的pH列于下表(已知:偏铝酸钡易溶于水).以下推断正确的是( )| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | ||
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| A. | 据图计算原溶液中c(Cl-)=c(SO42-) | |
| B. | OA段产生的沉淀为BaSO4和Fe(OH)3 | |
| C. | AB段可能发生的反应是:2SO42-+2Ba2++Al3++30H-=2BaSO4k+Al(OH)3↓ | |
| D. | C点溶液呈碱性的原因是AlO2-水解,其离子方程式为:AlO2-+2H2O=Al(OH)3+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在强碱性溶液中:Na+、K+、AlO2-、Cl- | |
| B. | pH=1的溶液中:HCO3-、NH4+、NO3-、Ca2+ | |
| C. | 无色溶液中:Cu2+、NO3-、Cl-、H+ | |
| D. | 无色溶液中:Na+、K+、ClO-、SO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
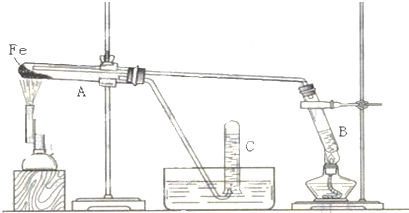
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
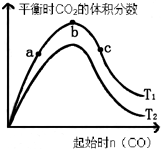 近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:| t/s | 0 | 10 | 20 | 30 | 50 |
| c(CO)mol/L | 3 | 1.8 | 1.2 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,4,4-三甲基戊烷 | B. | 4-甲基-2-戊烯 | ||
| C. | 4-甲基-5-乙基庚烷 | D. | 1,2,4-三甲基丁烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com