
AgCl(s)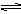 Ag+(aq)+Cl-(aq),平衡时,Ksp=C(Ag+ )·C(Cl-)
,过量氯化银分别投入①100 mL水
②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
Ag+(aq)+Cl-(aq),平衡时,Ksp=C(Ag+ )·C(Cl-)
,过量氯化银分别投入①100 mL水
②24 mL 0.1 mol·L-1NaCl ③10 mL 0.1 mol·L-1MgCl2 ④30 mL 0.1 mol·L-1AgNO3溶液中,溶液中C(Ag+)由大到小顺序为
A、③①②④ B、④①②③ C、①②③④ D、④③②①
科目:高中化学 来源: 题型:
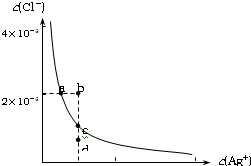 某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)
某温度时,AgCl在水中的沉淀溶解平衡曲线如图所示(提示:AgCl(s)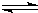 Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )
Ag+(aq)+Cl-(aq),其平衡常数Ksp=c(Ag+)?c(Cl-),称为溶度积常数;又知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2S)=6.3×10-50).下列说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
- 3 |
- 3 |
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com