
| A. | 4 mol A+2 mol B | |
| B. | 1 mol B+3 mol C+1 mol D | |
| C. | 3 mol C+2 mol D | |
| D. | 1 mol A+0.5 mol B+1.5 mol C+0.5 mol D |
分析 A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动;
B.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,与原平衡相比平衡向正反应方向移动;
C.等效为开始加入2molA+1molB+1molD,相当于在原平衡的基础上在加入1molD,与原平衡相比平衡向逆反应方向移动;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡.
解答 解:A.等效为在原平衡的基础上压强增大一倍到达的平衡状态,与原平衡相比平衡向逆反应方向移动,C的物质的量减小大于混合气体总物质的量减小,故C的物质的量百分含量降低,故A错误;
B.等效为开始加入2molA+2molB,相当于在原平衡的基础上在加入1molB,平衡向正反应方向移动,故C的物质的量百分含量增大,故B错误;
C.等效为开始加入2molA+1molB+1molD,相当于在原平衡的基础上在加入1molD,与原平衡相比平衡向逆反应方向移动,则C的物质的量百分含量降低,故C错误;
D.等效为开始加入2molA+1molB,与原平衡为完全等效平衡,C的物质的量百分含量不变等于w,故D正确;
故选D.
点评 本题考查等效平衡、化学平衡影响因素等,难度中等,构建平衡建立的途径是解题关键.


科目:高中化学 来源: 题型:实验题
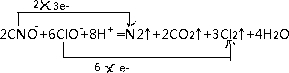 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
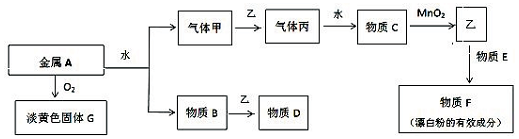
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
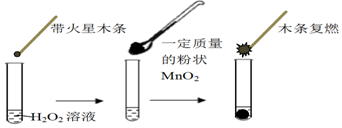
| MnO2的质量/g | 0.1 | 0.2 | 0.4 |
| 40s末O2体积/mL | 49 | 61 | 86 |
| 试管 | Ⅰ | Ⅱ | Ⅲ |
| 滴加试剂 | 5滴0.1mol•L-1FeCl3 | 5滴0.1mol•L-1 CuCl2 | 5滴0.3mol•L-1 NaCl |
| 产生气 泡情况 | 较快产生细小气泡 | 缓慢产生细小气泡 | 无气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
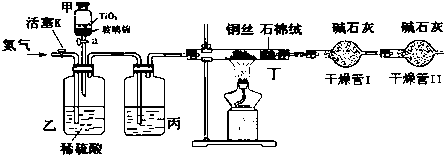
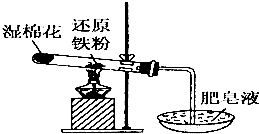 常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.
常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应.小明设计如下实验探究铁粉与水蒸气反应后的气体产物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
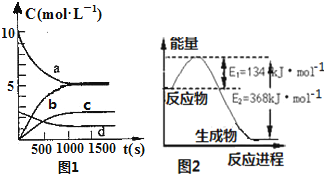 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,减少氮的氧化物在大气中的排放是环境保护的重要内容之一.| t(s) | 0 | 500 | 1000 | 1500 |
| n(NO2)(mol) | 20 | 13.96 | 10.08 | 10.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| B. | 对于能够自发进行的吸热反应,其原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| C. | △H<0、△S>0的反应在温度低时不能自发进行 | |
| D. | 在其他外界条件不变的情况下,使用催化剂,可以改变化学反应进行的方向 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com