

| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管1中, | 样品全部溶解,得到澄清的溶液. |
| 步骤2. 步骤3. |
| ||
| ||
| ||
| ||
| ||
| 操作步骤 | 预期现象和结论 |
| 步骤1.取少量样品于试管1中,加入足量的3mol?L-1H2SO4,充分振荡. | |
| 步骤2.取少许上述溶液于试管2,加入足量铁粉,充分振荡;再加入足量3mol?L-1H2SO4,充分振荡. 步骤3.取少许步骤1溶液于试管中3,逐滴加入0.01 mol?L-1酸性KMnO4溶液. (步骤2和步骤3的操作和现象结论可以互换位置) | 若试管中出现红色固体,说明试样中有CuO 如果紫红色褪去,说明试样中有FeO |
| ||
|


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| A、(NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 |
B、苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为 |
| C、醋酸和硬脂酸互为同系物,C6H14和C9H20也一定互为同系物 |
D、叶酸的结构为 ,它可以发生酯化、水解、加成等反应 ,它可以发生酯化、水解、加成等反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 键长/(pm) | B-F | B-Cl | B-Br |
| 计算值 | 152 | 187 | 199 |
| 实测值 | 130 | 175 | 187 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:
(1)判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性就越强.含氧酸酸性强弱与非羟基氧原子数的关系如下表所示:| 名称 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
| 结构式 | Cl-OH | 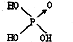 | 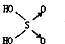 | 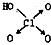 |
| 非羟基氧原子数 | 0 | 1 | 2 | 3 |
| 酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学反应 | 平衡常数 | 温度 | |
| 973K | 1173K | ||
| ①Fe(s)+CO2(g)?FeO(s)+CO(g) | K1 | 1.47 | 2.15 |
| ②Fe(s)+H2O(g)?FeO(s)+H2(g) | K2 | 2.38 | 1.67 |
| ③CO(g)+H2O(g)?CO2(g)+H2(g) | K3 | ? | ? |

查看答案和解析>>
科目:高中化学 来源: 题型:
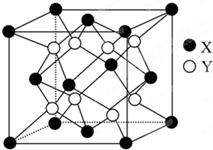 某离子晶体的晶体结构如图所示,试求:
某离子晶体的晶体结构如图所示,试求:查看答案和解析>>
科目:高中化学 来源: 题型:
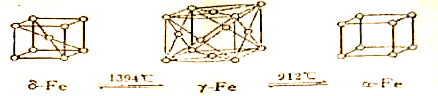
| A、δ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有8个 |
| B、γ-Fe晶体中与相邻铁原子距离相等且最近的铁原子有12个 |
| C、将铁加热到1500℃分别急速冷却和缓慢冷却,得到的晶体结构不相同,但化学性质几乎相同 |
| D、α-Fe晶胞边长若为a cm,γ-Fe晶胞边长若为b cm,则α-Fe和γ-Fe两种晶体的密度比为b3:a3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com