
| A. | 利用过滤分离溶液和胶体 | |
| B. | 用渗析法可以除去溶液中的胶体粒子 | |
| C. | 向氢氧化钠溶液中边滴加饱和FeCl3溶液边振荡制备Fe(OH)3胶体 | |
| D. | 向Fe(OH)3胶体中加入足量稀盐酸后,依然有丁达尔效应 |
分析 A.溶液和胶体都能透过滤纸;
B.溶液能透过半透膜,胶体不能透过半透膜;
C.制取氢氧化铁胶体方法:向沸水中滴入几滴饱和氯化铁溶液加热至液体呈红褐色为止;
D.胶体遇电解质溶液发生聚沉现象,过量稀盐酸能和氢氧化铁反应生成氯化铁,溶液没有丁达尔效应.
解答 解:A.溶液和胶体都能透过滤纸,所以不能用过滤方法分离溶液和胶体,应该用渗析方法分离溶液和胶体,故A错误;
B.溶液能透过半透膜,胶体不能透过半透膜,所以可以用渗析法分离溶液和胶体,故B正确;
C.制取氢氧化铁胶体方法:向沸水中滴入几滴饱和氯化铁溶液加热至液体呈红褐色为止,氢氧化钠和氯化铁反应生成氢氧化铁沉淀,故C错误;
D.胶体遇电解质溶液发生聚沉现象,过量稀盐酸能和氢氧化铁反应生成氯化铁,最后得到的是溶液,溶液没有丁达尔效应,所以不再产生丁达尔效应,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及物质分离和提纯、物质制备、胶体性质,明确实验原理、物质性质差异性是解本题关键,注意:胶体能透过滤纸,但不能透过半透膜,易错选项是C.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
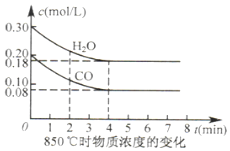 汽车尾气是造成雾霾天气的原因之一.
汽车尾气是造成雾霾天气的原因之一.| 起始物质的量 | 甲 | 乙 | 丙 |
| n(H2O)/mol | 0.10 | 0.20 | 0.20 |
| n(CO)/mol | 0.10 | 0.10 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
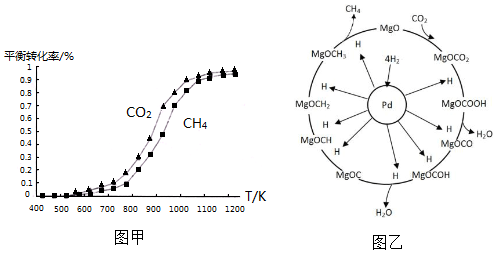 ①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应.
①同温度下CO2的平衡转化率大于(填“大于”或“小于”)CH4的平衡转化率,其原因是CO2发生了其他副反应. CH4+2H2O.
CH4+2H2O.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在无色的溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在pH=11的溶液中:CO32-、Na+、NO3-、SO42- | |
| C. | 水电离出的c(H+)=10-12mol•L?1的溶液中:Cl-、HCO3-、NO3-、NH4+ | |
| D. | 在酸性溶液中:Na+、NH4+、SO42-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
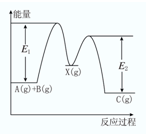 反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )
反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1,②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A(g)+B(g)→X(g)的活化能,下列说法正确的是( )| A. | △H=E1-E2 | B. | E1是反应①的活化能 | ||
| C. | X是反应A(g)+B(g)→C(g)的催化剂 | D. | △H2>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 50mL 1 mol•L-1 NaCl溶液 | B. | 100mL2 mol•L-1 AlCl3溶液 | ||
| C. | 100mL1 mol•L-1 NH4Cl溶液 | D. | 150mL2 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 碳酸钙溶液跟盐酸反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| C. | 盐酸跟氢氧化镁溶液反应:H++OH-═H2O | |
| D. | 氢氧化钡跟硫酸铜反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com