
【题目】现有一种蓝色晶体,可表示为MxFey(CN)6,经X 射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如下图所示。下列说法中正确的是( )
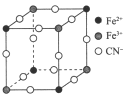
A. 该晶体的化学式为MFe2(CN)6
B. 该晶体属于离子晶体,M呈+3价
C. 该晶体属于离子晶体,M呈+2价
D. 晶体中与每个Fe3+距离最近且等距离的CN-为3个
【答案】A
【解析】
Fe3+和Fe2+互相占据立方体互不相邻的顶点,则该结构单元中,所含Fe3+有![]() 个,Fe2+有
个,Fe2+有![]() 个,CN-有
个,CN-有![]() 个。由于该晶体的化学式为MxFey(CN)6,所以y=2,且该晶体的化学式中含有1个Fe3+、1个Fe2+,所以x为1,即该化学式为MFe2(CN)6。
个。由于该晶体的化学式为MxFey(CN)6,所以y=2,且该晶体的化学式中含有1个Fe3+、1个Fe2+,所以x为1,即该化学式为MFe2(CN)6。
A. 经计算得知,该结构单元中,含有![]() 个Fe2+、
个Fe2+、![]() 个Fe3+、3个CN-。由于该晶体的化学式为MxFey(CN)6,则y=2,x=1,即该化学式为MFe2(CN)6,A正确;
个Fe3+、3个CN-。由于该晶体的化学式为MxFey(CN)6,则y=2,x=1,即该化学式为MFe2(CN)6,A正确;
B. 从构成晶体的微粒来看,该晶体为离子晶体;由于化学式为MFe2(CN)6,M呈+1价,B错误;
C. 该晶体为离子晶体;由于化学式为MFe2(CN)6,M呈+1价,C错误;
D. 晶体中与每个Fe3+距离最近且等距离的CN-为6个,D错误;
故合理选项为A。


科目:高中化学 来源: 题型:
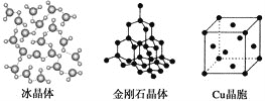
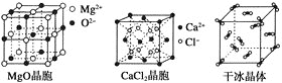
【题目】下列各图为几种晶体或晶胞的构型示意图。
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。回答下列问题:
(1)正丁烷(C4H10)脱氢制1-丁烯(C4H8)的热化学方程式如下:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ ![]() O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ ![]() O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为________ kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x_____________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是__________(填标号)。
A.升高温度 B.降低温度 C.增大压强 D.降低压强

(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。图(b)为丁烯产率与进料气中n(氢气)/n(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,其降低的原因是___________。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。丁烯产率在590℃之前随温度升高而增大的原因可能是___________、____________;590℃之后,丁烯产率快速降低的主要原因可能是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于苯乙烯(![]() ),下列叙述完全正确的是( )
),下列叙述完全正确的是( )
①能使酸性 KMnO4溶液褪色;②可发生加聚反应;③可溶于水;④可溶于苯中;⑤苯环能与溴水发生取代反应;⑥可与 H2 发生加成反应,最多需要4molH2
A. ①②③B. ①②④⑥
C. ①②④⑤⑥D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
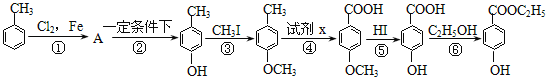
【题目】工业上用甲苯生产对-羟基苯甲酸乙酯:![]() ,下列反应①—⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明。
,下列反应①—⑥是其合成过程,其中某些反应条件及部分反应物或生成物未注明。
回答下列问题:
(1)有机物A的结构简式为___________________。A的名称为 。
(2)反应①的化学方程式是:____________________________________。
(3)试剂x是___________。
(4)反应⑥的化学方程式是:_____________________________________。
(5)合成路线中设计③、⑤两步反应的目的是_____________
(6)CH3O-![]() -COOH的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有 种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为 (写结构简式)。
-COOH的同分异构体中,既能与NaHCO3发生反应,又能与FeCl3溶液发生显色反应的共有 种,其中核磁共振氢谱为5组峰,且峰面积比为2∶2∶2∶1∶1的为 (写结构简式)。
(7)已知:![]() ,写出以苯酚和乙醇为原料制备
,写出以苯酚和乙醇为原料制备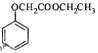 的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
的合成路线流程图(无机试剂任用)。合成路线流程图例如下:
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域.单位质量的![]() 和
和![]() 单质燃烧时均放出大量热,可用作燃料.已知
单质燃烧时均放出大量热,可用作燃料.已知![]() 和
和![]() 为短周期元素,其原子的第一至第四电离能如下表所示:
为短周期元素,其原子的第一至第四电离能如下表所示:
电离能/ |
|
|
|
|
| 932 | 1821 | 15390 | 21771 |
| 738 | 1451 | 7733 | 10540 |
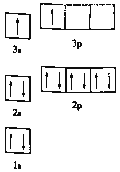
①某同学根据上述信息,推断![]() 的核外电子排布如图所示,该同学所画的电子排布图违背了_________,
的核外电子排布如图所示,该同学所画的电子排布图违背了_________, ![]() 元素位于周期表五个区域中的___ 区。
元素位于周期表五个区域中的___ 区。
②![]() 分子的中心原子
分子的中心原子![]() 采取_________杂化,
采取_________杂化, ![]() 的空间构型为___ 。
的空间构型为___ 。
(2)![]() 原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
原子或离子外围有较多能量相近的空轨道,所以其能与一些分子或离子形成配合物。
① 与![]() 原子或离子形成配合物的分子或离子应具备的结构特征是____。
原子或离子形成配合物的分子或离子应具备的结构特征是____。
② 六氰合亚铁离子![]() 中不存在____________(填字母)。
中不存在____________(填字母)。
A.共价键 B.非极性键 C.配位键 D. ![]() 键
键
写出一种与![]() 互为等电子体的单质的分子式:________________ 。
互为等电子体的单质的分子式:________________ 。
(3)—种![]() 合金的晶胞结构如图,请据此回答下列问题:
合金的晶胞结构如图,请据此回答下列问题:
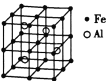
① 该合金的化学式为____________。
② 若晶体的密度为![]()
![]() ,则该晶胞棱长为____________
,则该晶胞棱长为____________![]() (设
(设![]() 为阿伏加德罗常数的值,用含
为阿伏加德罗常数的值,用含![]() 和
和![]() 的代数式表示,不必化简)。
的代数式表示,不必化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCH4和适量的氧气在密闭容器中点燃,充分反应后,甲烷和氧气均无剩余,且产物均为气体(101kPa,120℃),其总质量为72g,下列有关叙述不正确的是( )
A.若将产物通过碱石灰,则可全被吸收,若通过浓硫酸,则不能被完全吸收
B.产物的平均摩尔质量为24g/mol
C.若将产物通过浓硫酸充分吸收后恢复至(101kPa,120℃),则体积变为原来的![]()
D.反应中消耗的氧气为1.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置可验证同主族元素非金属性的变化规律。
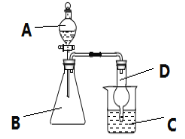
(1)若要证明非金属性:Cl>I,则A中加浓盐酸,B中加KMnO4,(KMnO4与浓盐酸常温下反应生成氯气),C中加淀粉碘化钾混合溶液,观察到C中溶液___的现象,即可证明。从环保角度考虑,此装置缺少尾气处理装置,可用___溶液吸收尾气。请写出一种制氯气的化学反应方程式:___。
(2)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液,观察到C中溶液___的现象,即可证明。但有的同学认为盐酸具有挥发性,可进入C中干扰实验,应在两装置间添加装有___溶液的洗气瓶。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com