
【题目】铁、铜及其化合物在日常生产、生活中有着广泛的应用。请回答下列问题:
(1)铁在元素周期表中的位置是____,基态铁原子的核外电子排布式为_________。
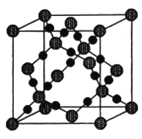
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于________晶体(填晶体类型)。CO2在高温高压下所形成的晶体其晶胞如下图所示。则该晶体的类型属于_________晶体(填晶体类型)。
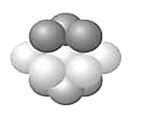
(3)铜晶体中铜原子的堆积方式如下图所示。其中铜原子的配位数为_______。
(4)CuCl2和CuCl是铜的两种常见的氯化物。
①下图表示的是________(填“CuCl2”或“CuCl”)的晶胞。
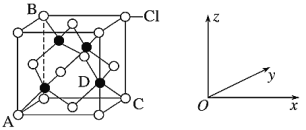
②原子坐标参数表示晶胞内部各原子的相对位置。上图中各原子坐标参数A为(0,0,0);B为(0,1,1);C为(1,1,0);则D原子的坐标参数为_______。
③图示晶胞中C、D两原子核间距为298pm,阿伏加德罗常数的值为NA,则该晶体密度为_____g·cm-3。(列出计算式即可)相对原子质量:Cu 64 Cl 35.5
【答案】第四周期第Ⅷ族 [Ar]3d64s2 或1s22s22p63s23p63d64s2 分子晶体 原子晶体 12 CuCl (![]() ,
,![]() ,
,![]() )
) 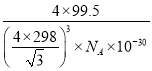 g/cm3
g/cm3
【解析】
(1)铁元素位于第四周期第Ⅷ族;
(2)根据晶体的性质进行判断;
(3)金属铜采用面心立方最密堆积;
(4)①根据均摊法计算;
②根据空间结构判断D原子的坐标参数;
③结合晶体计算公式进行计算。
(1)铁元素位于第四周期第Ⅷ族;为26号元素,基态铁原子的核外电子排布式为[Ar]3d64s2 或1s22s22p63s23p63d64s2;
(2)晶体熔沸点较低,所以属于分子晶体;
由CO2在高温高压下所形成的晶体的晶胞图可知,在晶胞中原子之间通过共价键结合,形成空间网状结构的晶体,属于原子晶体;
(3)金属铜采用面心立方最密堆积,其配位数=3×8×![]() =12;
=12;
(4)①晶胞中Cl-的个数为8![]() +6
+6![]() =4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
=4,Cu的个数为4,则化学式为CuCl,属于CuCl的晶胞;
②D与周围4个原子形成正四面体结构,D与顶点C的连线处于晶胞体对角线上,且DC间距离为对角线的![]() 处,则D原子的坐标参数为(
处,则D原子的坐标参数为(![]() ,
,![]() ,
,![]() );
);
③已知一个晶胞中含有4个CuCl,设晶胞的边长为a,则CD间距离为![]() a,则a=
a,则a=![]() pm,则晶胞的体积为a3,晶胞的密度为
pm,则晶胞的体积为a3,晶胞的密度为![]() =
=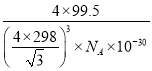 g/cm3。
g/cm3。


科目:高中化学 来源: 题型:
【题目】已知反应:2NO2(红棕色)![]() N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
N2O4(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是( )
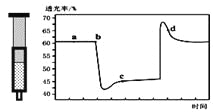
A. b点的操作是压缩注射器
B. c点与a点相比,c(NO2)增大,c(N2O4)减小
C. d 点:v(正)>v(逆)
D. 若不忽略体系温度变化,且没有能量损失,则T(b)>T(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或对实验事实的叙述中存在错误的是 ( )
A.用50mL酸式滴定管准确量取23.20mL酸性KMnO4溶液,放入锥形瓶中待用
B.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
C.酸碱中和滴定时,锥形瓶未用待装液润洗。
D.用惰性电极电解NaCl溶液,一段时间后,再加盐酸,可使溶液与原溶液完全一样。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是

A.从CH4、NH4+、SO42-为正四面体结构,可推测PH4+、PO43-也为正四面体结构
B.元素Ge位于周期表第四周期IVA族,核外电子排布式为 [Ar]4s24p2,属于P区
C.HF晶体沸点高于HCl,是因为 HCl共价键键能小于HF
D.某气态团簇分子结构如图所示,该气态团簇分子的分子式为EF或FE
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活和社会密切相关。下列有关说法不正确的是![]()
A.发展“低碳经济”能够减少对化石能源的依赖
B.明矾溶于水会生成氢氧化铝胶体,故可用明矾作净水剂
C.铁制品在潮湿的空气中生锈,其主要原因是发生了析氢腐蚀
D.处理含![]() 的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
的废水,常用FeS作沉淀剂,是因为CuS的溶解度比FeS小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向0.01 mol·L1的醋酸溶液中滴入pH=7的醋酸铵溶液,溶液pH随滴入醋酸铵溶液体积变化的曲线示意图如右图所示。下列分析正确的是
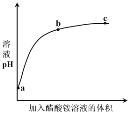
A.a点,pH = 2
B.b点,c(CH3COO-) > c(NH4+)
C.c点,pH可能大于7
D.ac段,溶液pH增大是CH3COOH![]() H+ + CH3COO-逆向移动的结果
H+ + CH3COO-逆向移动的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 molL-1的4种钠盐溶液pH如下:
溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中不正确的是
A. 四种溶液中,Na2CO3溶液中水的电离程度最大
B. 向氯水中加入NaHCO3(s),可以增大氯水中次氯酸的浓度
C. NaHSO3溶液显酸性的原因是:NaHSO3=Na++H++SO32-
D. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH最小的是H2SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是
A.常温下,l mol C6H12中含碳碳键的数目一定小于6NA
B.18g果糖分子中含羟基数目为0.6NA
C.4.0g由H218O与D216O组成的混合物中所含中子数为2NA
D.50g质量分数为46%的乙醇溶液与足量的钠反应,放出H2的分子数目为0.25NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据碘与氢气反应的热化学方程式
① I2(g)+ H2(g)![]() 2HI(g) ΔH=-9.48 kJ/mol
2HI(g) ΔH=-9.48 kJ/mol
② I2(s)+ H2(g)![]() 2HI(g) ΔH=+26.48 kJ/mol
2HI(g) ΔH=+26.48 kJ/mol
下列判断正确的是
A.254g I2(g)中通入2gH2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应②的反应物总能量比反应①的反应物总能量低
D.反应①的产物比反应②的产物稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com