
【题目】那可丁是一种药物,为支气管解痉性镇咳药,能解除支气管平滑肌痉挛,抑制肺牵张反射引起的咳嗽,化合物H是制备该药物的重要中间体,合成路线如图:
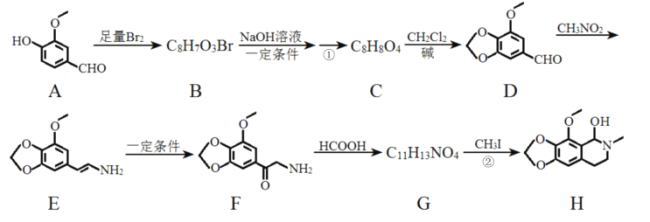
已知:
a.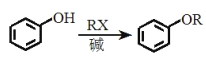 ;
;
b.RNH2![]() RNHCH3。
RNHCH3。
(1)反应①的条件为__。
(2)反应②的反应类型为__。
(3)化合物G的结构简式为__。
(4)下列说法正确的是__。
a.物质D能与FeCl3发生显色反应
b.物质F具有碱性
c.物质G能和银氨溶液发生反应
d.物质H的分子式是C12H15NO4
(5)写出C→D的化学方程式:__。
(6)满足下列条件,化合物A所有同分异构体有__种(不包括A)。
①可以与活波金属反应生成氢气,但不与NaHCO3溶液反应;
②分子中含有![]() 结构;
结构;
③含有苯环,且有两个取代基。
(7)已知CH2=CHCH3![]() CH2=CHCH2Cl,请以
CH2=CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物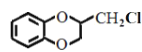 ,写出制备的合成路线流程图(无机试剂任选)__。
,写出制备的合成路线流程图(无机试剂任选)__。
【答案】H+或酸化 取代反应 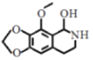 bd
bd  +CH2Cl2+2NaOH
+CH2Cl2+2NaOH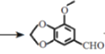 +2NaCl+2H2O或
+2NaCl+2H2O或 +CH2Cl2
+CH2Cl2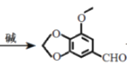 +2HCl 12
+2HCl 12 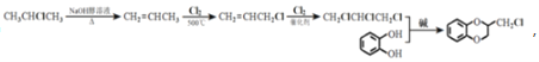
【解析】
A到B为酚羟基的邻对位与溴发生取代,故B的结构为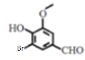 ;B到C为卤素原子在碱性条件下水解成酚钠后酸化,故C的机构为
;B到C为卤素原子在碱性条件下水解成酚钠后酸化,故C的机构为 ;由已知条件b,结合H的结构可推知化合物G的结构简式为
;由已知条件b,结合H的结构可推知化合物G的结构简式为 。
。
(1)反应①为酚钠和酸反应生成酚羟基,所以该反应的条件为H+或酸化,故答案为:H+或酸化;
(2)G中的H原子被甲基取代,所以反应②的反应类型为取代反应,故答案为:取代反应;
(3)化合物G的结构简式为 ,故答案为:
,故答案为: ;
;
(4)a.物质D不含酚羟基,所以不能与FeCl3发生显色反应,故错误;
b.F含有氨基,所以物质F具有碱性,故正确;
c.G为 ,不含醛基,所以G不能和银氨溶液发生反应,故错误;
,不含醛基,所以G不能和银氨溶液发生反应,故错误;
d.物质H的分子式是C12H15NO4,故正确;
故选bd;
(5)C发生信息a的反应生成D,C→D的化学方程式:
 ,
,
(6)化合物A的同分异构体符合下列条件:
①可以与活波金属反应生成氢气,但不与NaHCO3溶液反应,说明含有酚羟基或羟基,不含羧基;
②分子中含有![]() 结构,说明具有酯基;
结构,说明具有酯基;
③含有苯环,且有两个取代基,
如果取代基为-OH、-COOCH3,有邻间对3种结构;
如果取代基为-OH、HCOOCH2-、有邻间对3种结构;
如果取代基为-OH、CH3COO-,有邻间对3种结构;
取代基为-CH2OH、HCOO-,有邻间对3种结构,
所以符合条件的有12种,
故答案为:12;
(7)以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() 和ClCH2CHClCH2Cl发生信息a的反应得到,ClCH2CHClCH2Cl可由CH2=CHCH2Cl发生加成反应得到,CH2=CHCH2Cl可由CH2=CHCH3发生取代反应得到,CH2=CHCH3可由
和ClCH2CHClCH2Cl发生信息a的反应得到,ClCH2CHClCH2Cl可由CH2=CHCH2Cl发生加成反应得到,CH2=CHCH2Cl可由CH2=CHCH3发生取代反应得到,CH2=CHCH3可由 ,
,
故答案为: 。
。


科目:高中化学 来源: 题型:
【题目】用如图所示装置测定镁带样品中单质的质量分数(杂质与酸反应不产生气体)。完成下列填空:
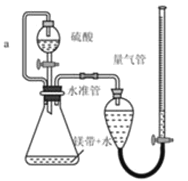
(1)用离子方程式表示该实验的反应原理:____________。
(2)称量镁带所需的定量仪器是 _______________。
(3)硫酸必须过量的目的是_____________。
(4)导管a的作用是 ____________ 。
(5)如果测定结果偏高,可能的原因是____________。(选填编号)
a 装置漏气 b 未冷却至室温即读数
c 镁带中含有氧化镁 d未读数时量气管的液面低于水准管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列方程式:8Fe+30HNO3→8Fe(NO3)3+3N2O↑+15H2O
(1)标出上述反应电子转移的方向和总数______。
(2)上述反应中______元素被还原,氧化产物为______,若反应中生成标准状态下的N2O气体2.24L则转移的电子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用浓硫酸和乙醇混合加热制取乙烯。请填空:
(1)实验室制乙烯的化学方程式为_______,实验室用乙醇和浓硫酸反应制取乙烯,可选用的装置是_____
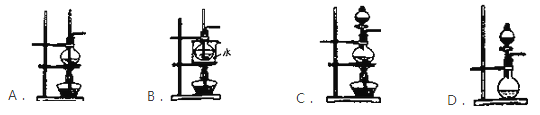
(2)关于该实验的说法中正确的是____________
a 浓硫酸只作催化剂
b 可用向下排空气法收集乙烯
c 在反应容器中放入几片碎瓷片防止混合液暴沸
d 温度计应插入反应溶液液面下,以便控制温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表中的前四周期,①~⑨为相应的元素,请从中选择合适的元素回答问题:
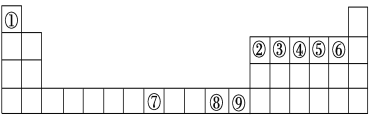
(1)根据元素原子的外围电子排布特征,元素周期表可划分为五个区域,⑨元素位于周期表的________区。
(2)④、⑥两元素形成的化合物的立体构型为________,其中心原子的杂化轨道类型为________。
(3)元素⑧的离子的氢氧化物不溶于水,但可溶于氨水中,该离子与NH3间结合的作用力为________。
(4)在周期表给出的9种元素中,电负性最大的元素基态原子的电子排布式为___________。
(5)在①与④形成的相对分子质量最小的化合物A中,元素④的杂化类型是____,写出与化合物A互为等电子体的一种阳离子______(填离子符号)。
(6)关于元素①与元素⑤形成的1︰1的化合物,下列说法正确的是______(填字母序号)。
A.该化合物中的所有原子都满足最外层8电子稳定结构
B.该化合物分子中σ键和π键数目比为1︰1
C.该化合物是由极性键和非极性键形成的极性分子
D.该化合物分子的空间构型为直线形
(7)元素⑦与CO可形成X(CO)5型化合物,该化合物常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断该化合物晶体属于________晶体(填晶体类型),化合物中⑦的化合价为:_______。根据等电子体理论,该化合物的配体的结构式为:_______,CaC2中,阴离子的电子式为: ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 L苯含有的分子数约为NA
B.密闭容器中23 g NO2与N2O4的混合气体中氮原子数为0.5NA
C.1 L 0.1 mol·L-1的NaHCO3溶液中,HCO3- 和CO32- 离子数之和为0.1NA
D.密闭容器中1 mol N2(g)与3 mol H2 (g)反应制备氨气,形成6NA个N-H键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度分别为T1和T2时,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g),一段时间后达到平衡,反应过程中测定的数据如下表:
温度/K | t/min | t1 | t2 | t3 | t4 |
T1 | n(Y)/mol | 0.14 | 0.12 | 0.10 | 0.10 |
T2 | n(Y)/mol | 0.13 | 0.09 | 0.08 |
下列说法正确的是( )
A. 该反应的正反应为放热反应
B. T2温度下此反应的平衡常数K=4
C. 温度为T1时,0~t1时间段的平均速率υ(Z)=2.0×10-3mol·L-1·min-1
D. 在T1下平衡后,保持其他条件不变,再充入0.2molZ,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】交联聚合物K合成路线如下(图中表示链延长)
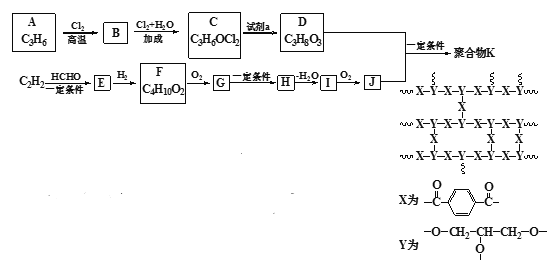
已知: ;
;

(1)按官能团分类,A的类别是__________。
(2)A→B的反应类型是________________。
(3)C可能的结构简式是__________。
(4)C→D所需的试剂a是__________。
(5)C2H2生成E的方程式是__________。
(6)G→H的方程式是__________。
(7)含有苯环,且与I互为同分异构体的酯有_____种。写出其中的一种结构简式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组有机化合物中,不论两者以什么比例混合,只要总物质的量一定,则完全燃烧时生成的水的质量和消耗氧气的质量不变的是
A. CH4O,C3H4O5B. C3H6,C3H8O
C. C3H8,C4H6D. C2H6,C4H6O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com