

分析 (1)根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化;
(2)A.②金刚石、④晶体硅、⑥碳化硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体,C-Si键长小于Si-Si,熔点:碳化硅>晶体硅;
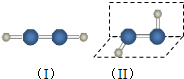
B.①干冰是直线型分子,属于分子晶体;③四氯化碳是正四面体型分子晶体;⑧氖是由单原子分子构成的分子晶体四氯化碳的电子式为
C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1.
解答 解:(1)①速率之比等于对应物质的化学计量数之比,反应开始后一直成立,不能说明反应达到平衡状态,故①错误;
②当体系达平衡状态时,反应混合物各组分的物质的量浓度不变,故②正确;
③该反应正方向为计量数减小的反应,随着反应进行压强不断减小,当压强不变时,反应达到平衡状态,故③正确;
④反应容器的体积不变,气体的质量守恒,所以密度始终不变,密度不变时不能说明反应达到平衡状态,故④错误;
⑤单位时间内生成n mol N2表示逆速率,生成3n mol H2表示逆速率,都表示逆速率,不能说明反应达到平衡状态,故⑤错误
⑥2V(N2正)=V(NH3逆),即氮气的正速率与氨气的逆速率之比等于计量数之比,则反应达到平衡状态,故⑥正确;
⑦单位时间内3molH-H键断裂等效于6mol N-H键形成,同时6mol N-H键断裂,故⑦错误;
⑧混合气体的物质的量逐渐减小,质量不变,则平均相对分子质量逐渐增大,当平均相对分子质量不变时,即是平衡状态,故⑧正确;
故答案为:②③⑥⑧;
(2)A.②金刚石、④晶体硅、⑥碳化硅是通过非极性键形成的原子晶体;②金刚石是熔点最高的晶体C-Si键长小于Si-Si,熔点:碳化硅>晶体硅;
故答案为:②④⑥;②⑥④;
B.①干冰是直线型分子,属于分子晶体;③四氯化碳是正四面体型分子晶体;⑧氖是由单原子分子构成的分子晶体四氯化碳的电子式为
故答案为:①③⑧;
C.⑤过氧化钠既含有离子键,又含有非极性共价键,其阳离子个数与阴离子个数之比为2:1,
故答案为:⑤;2:1.
点评 本题考查了化学平衡状态的判断、晶体的类型和化学键等,题目涉及的内容较多,侧重于考查学生对所学知识的综合应用能力,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:
过氧化氢是应用广泛的“绿色”氧化剂,酸性条件下稳定,中性或弱碱性条件下易分解.填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
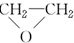 (环氧乙烷).
(环氧乙烷).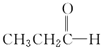 $\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH
$\stackrel{NaBH_{4}}{→}$CH3CH2CH2OH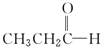 $→_{HCl}^{Zn(Hg)}$CH3CH2CH3
$→_{HCl}^{Zn(Hg)}$CH3CH2CH3查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①和② | B. | 只有②③④ | C. | ①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
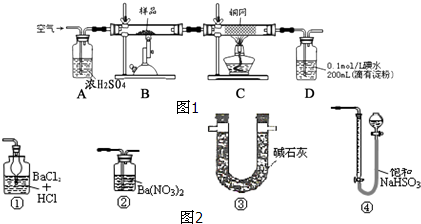
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
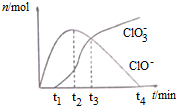
| A. | t1时,溶液中Na+、NH4+、CO32-、S2-可以大量共存 | |
| B. | t2时,溶液中含氯微粒浓度大小:c(ClO-)>c(Cl-)>c(ClO3-) | |
| C. | t3时,离子方程式为:4Cl2+8OH-=ClO3-+ClO-+6Cl-+4H2O | |
| D. | t4时,因c(ClO-)接近于0,所以c(ClO3-)=c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤和结论(不要求写具体操作过程): |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
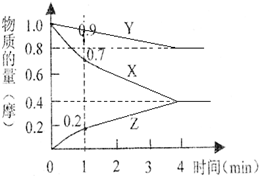 某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.
某温度时,2L的密闭容器中X、Y、Z三种物质的物质的量随时间的变化如下图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 19世纪初,化学家维勒提出了有机化学的概念 | |
| B. | 红外光谱图的研究可以确定有机物的相对分子质量 | |
| C. | 测定有机化合物中碳、氢元素质量分数的方法最早由李比希提出的 | |
| D. | 铜丝燃烧法可定性确定有机物中是否含有硫、氮、氯、溴等元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com