
| A. | ③④⑤⑥⑦ | B. | ③④⑥ | C. | ④⑥⑦ | D. | ①③④⑤ |
分析 既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色,则有机物中含碳碳双键或三键,或无机物具有还原性,以此来解答.
解答 解:①甲苯只能使高锰酸钾褪色,故不选;
②苯不能使高锰酸钾、溴的四氯化碳溶液褪色,故不选;
③聚乙烯中不含碳碳双键,不能使高锰酸钾、溴的四氯化碳溶液褪色,故不选;
④2-丁炔中含碳碳三键,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色,故选;
⑤环己烷不能使高锰酸钾、溴的四氯化碳溶液褪色,故不选;
⑥1,3-丁二烯中含碳碳双键,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色,故选;
⑦SO2 具有还原性,既能使酸性高锰酸钾溶液褪色,又能使溴的四氯化碳溶液褪色,故选;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意有机物的氧化与加成反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Fe(OH)3中加入氢溴酸:Fe(OH)3+3H+═Fe3++3H2O | |
| C. | 向Fe(NO3)2稀溶液中加入盐酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 向NaHCO3溶液中加入过量的Ba(OH)2溶液:Ba2++2HCO3-+2OH-═BaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TiCl4是还原剂 | B. | Na被氧化 | ||
| C. | Na得到电子 | D. | TiCl4发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:
二甲醚(CH3OCH3)被称为21世界的新型燃料,在未来可能替代汽油、液化气、煤气等并具有优良的环保性能.工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
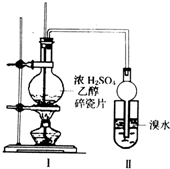 某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.
某化学兴趣小组用如图所示装置进行探究实验.以验证产物中有乙烯生成且乙烯具有不饱和性.当温度迅速上升后,可观察到试管中溴水褪色,烧瓶中浓H2SO4与乙醇的混合液体变为棕黑色.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com