
【题目】氢能被誉为21世纪的“终极能源”,具有高效、高压、环保、体积小等特点,氢能转化被视为新能源汽车终极解决方案,也是资本与技术趋之若鹜的领域。镧镍合金LaNix是一种良好的储氢材料。工业上可用下列方法冶炼镍。
![]()
(1)一个电子的运动状态取决于________种因素,基态Ni原子核外电子占据_____个不同原子轨道。
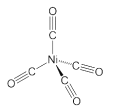
(2)CO分子内σ键和π键个数之比为________;已知Ni(CO)4的结构如图所示,中心原子Ni的杂化类型为_________,Ni原子参与形成了______个配位键,Ni(CO)4属于______晶体,理由是________________________________。
(3)研究发现镧镍合金LaNix属六方晶系,其晶胞如图a中实线或图a所示,储氢位置有两种,分别是八面体空隙(“![]() ”)和四面体空隙(“
”)和四面体空隙(“![]() ”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。
”),见图b、c,这些就是氢原子存储处,有氢时,设其化学式为LaNixHy。

①LaNix合金中x的值为_______;
②晶胞中和“![]() ”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
”同类的八面体空隙有____个,和“▲”同类的四面体空隙有____个。
③若H进入晶胞后,晶胞的体积不变,H的最大密度是______________g/cm-3(保留2位有效数字,NA=6.0×1023![]() =1.7)。
=1.7)。
【答案】4 15 1:2 sp3 4 分子 Ni(CO)4不存在离子键,晶体的构成微粒是分子,微粒间的相互作用力是分子间作用力 5 3 6 0.18
【解析】
利用均摊法求出晶胞中的La与Ni的原子个数比,进而得出化学式;结合几何关系,找出六方晶胞的体积,再依据密度公式作答。
(1)一个电子的运动状态取决于它所处的电子层、电子亚层、轨道的空间伸展方向和自旋状态4种因素,基态Ni原子核外电子排布式为1s22s22p63s23p63d84s2,基态Ni原子核外电子占据15个不同原子轨道。
(2)CO分子内存在三键,σ键和π键个数之比为1:2; 由图可知,Ni(CO)4中心原子Ni的杂化类型为sp3,Ni原子参与形成了4个配位键,Ni(CO)4属于分子晶体,理由是Ni(CO)4不存在离子键,晶体的构成微粒是分子,微粒间的相互作用力是分子间作用力。
(3)①该晶体的晶胞不是六棱柱,而是实线部分表示的平行六面体,各原子在晶胞中的位置可参考a,b,如果将平行六面体抽取出来,晶胞如a’所示,La在顶点,Ni在面心有4个,其中顶层和底层各2个,均摊后各1个,前后左右4个面各1个,均摊后共2个;体心1个,故LaNix合金中x的值为5;
②根据b,c结构可知,晶胞中和“![]() ”同类的八面体空隙有3个,和“▲”同类的四面体空隙有6个。
”同类的八面体空隙有3个,和“▲”同类的四面体空隙有6个。
③六方晶胞的体积为V=a2csinθ=(500×10-10)2×400×10-10×sin60°=8.5×10-23,密度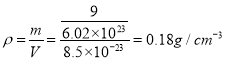 。
。


科目:高中化学 来源: 题型:
【题目】某化学实验室需要0.2mol/LNaOH溶液500mL和0.5mol/L硫酸溶液450mL。根据这两种溶液的配制情况回答下列问题:
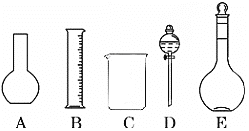
(1)如图所示的仪器中配制溶液肯定不需要的是_______(填序号),配制上述溶液还需用到的玻璃仪器是________________________________(填仪器名称)。
(2)现用质量分数为98%、密度为1.84gcm-3的浓硫酸来配制450mL、0.5molL-1的稀硫酸。计算所需浓硫酸的体积为______mL(保留1位小数),现有①10mL ②25mL③50mL ④100mL四种规格的量筒,你选用的量筒是_____(填代号).
(3)配制时,一般可分为以下几个步骤:
①量取②计算③稀释④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序
为:②→①→③→___→___→___→___→④(填序号)
(4)在配制过程中,其他操作都准确,下列操作中错误的是_______,能引起误差偏高的有___________(填代号)。
①洗涤量取浓硫酸后的量筒,并将洗涤液转移到容量瓶中
②未等稀释后的H2SO4溶液冷却至室温就转移到容量瓶中
③将浓硫酸直接倒入烧杯,再向烧杯中注入蒸馏水来稀释浓硫酸
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤转移前,容量瓶中含有少量蒸馏水
⑥定容摇匀后,发现液面低于标线,又用胶头滴管加蒸馏水至标线
⑦定容时,俯视标线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量相等的铁片和铜片用导线相连浸入500 mL硫酸铜溶液中构成如图1的装置:

(以下均假设反应过程中溶液体积不变)。
(1)铁片上的电极反应式为______________,
(2)铜片周围溶液会出现___________的现象。
(3)若2 min后测得铁片和铜片之间的质量差为1.2 g,计算:导线中流过的电子的物质的量为__________mol;
(4)金属的电化学腐蚀的本质是形成了原电池。如下图所示,烧杯中都盛有稀硫酸。
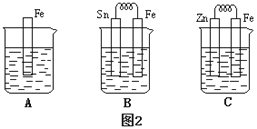
①图2 B中的Sn为________极,Sn极附近溶液的pH(填“增大”“减小”或“不变”)____。
②图2 C中被腐蚀的金属是___________。比较A、B、C中纯铁被腐蚀的速率由快到慢的顺序是______。
(5)人们应用原电池原理制作了多种电池,以满足不同的需要。燃料电池是一种高效、环境友好的供电装置,如图是电解质为稀硫酸溶液的氢氧燃料电池原理示意图,回答下列问题:
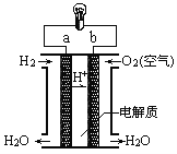
①氢氧燃料电池的正极电极反应是:___________________。电池工作一段时间后硫酸溶液的浓度_____________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于价电子构型3s23p4的描述正确的是( )
A. 它的元素符号为O
B. 它的核外电子排布式为1s22s22p63s23p4
C. 常温下,可以与H2化合生成液态化合物
D. 其电子排布图为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年9月起,澳大利亚山火已经持续100多天,产生了大量温室气体。有50mLNaOH溶液,向其中逐渐通入一定量的CO2,然后向溶液中逐滴加入0.1mol/L的稀盐酸,产生的CO2气体体积(标准状况)与所加入的盐酸的体积之间的关系如图所示。下列说法正确的是

A.滴加盐酸过程中,混合溶液的导电能力不断增强
B.滴加盐酸过程中,混合溶液中c(CO32-)、c(HCO3-)、c(H2CO3)之和不断减小
C.V(稀盐酸)=25mL时,c(H+)+c(H2CO3)=c(CO32-)+c(OH-)
D.V(稀盐酸)=50mL时,c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将TiO2转化为TiCl4是工业冶炼金属钛的主要反应之一。已知:
TiO2(s)+2Cl2(g)===TiCl4(l)+O2(g) ΔH=+140.5 kJ·mol-1
C(s,石墨)+O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
则反应TiO2(s)+2Cl2(g)+2C(s,石墨)===TiCl4(l)+2CO(g)的ΔH是
A.-80.5 kJ·mol-1 B.+30.0 kJ·mol-1
C.-30.0 kJ·mol-1 D.+80.5 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟"人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1 mol O2,有44 gCO2被还原
D. a电极的反应为:3CO2+ 16H+-18e-= C3H8O+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
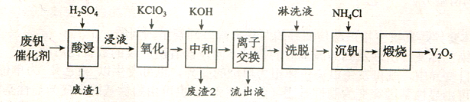
回答下列问题:
(1)“酸浸”时V2O5转化为VO2+,反应的离子方程式为___________,同时V2O4转成VO2+。“废渣1”的主要成分是__________________。
(2)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(3)“中和”作用之一是使钒以V4O124形式存在于溶液中。“废渣2”中含有_______。
(4)“离子交换”和“洗脱”可简单表示为:4ROH+ V4O124![]() R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
R4V4O12+4OH(以ROH为强碱性阴离子交换树脂)。为了提高洗脱效率,淋洗液应该呈_____性(填“酸”“碱”“中”)。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>t1)
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.20 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
下列说法正确的是( )
A.反应在t1min内的平均速率为v(H2)=![]() mol·L-1·min-1
mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60mol CO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C.保持其他条件不变,向平衡体系中再通入0.20mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
D.若温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com