
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
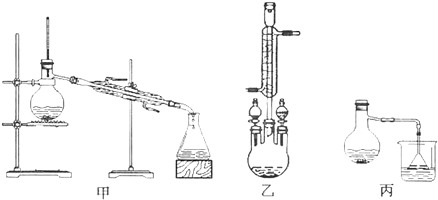
 实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
实验室用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
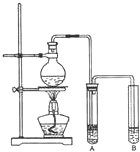 某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:
某研究性学习小组为合成1-丁醇,查阅资料得知一条合成路线:| 一定条件 |
| H2 |
| Ni4△ |

查看答案和解析>>
科目:高中化学 来源: 题型:
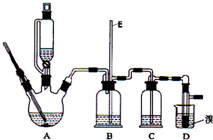
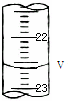 某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:
某实验中,用0.1000mol?L-1标准盐酸测定某NaOH溶液的浓度,其操作步骤如下:| 序号 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数V1(mL) | 滴定后读数V2(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 5.15 | 30.15 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Fe3+的氧化性比溴的氧化性强 |
| B、该晶体中一定含有SCN- |
| C、Fe2+与SCN-不能形成红色化合物 |
| D、Fe2+被溴氧化成Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
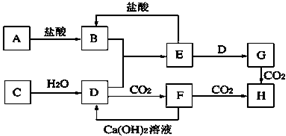 如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.
如图中A~H均为中学化学中常见的物质,它们之间有如下转化关系.其中C均为金属单质,H的焰色反应呈黄色,在通常状况下E跟NaOH或盐酸均可以发生反应.(反应过程中生成的水及其他产物已略去)请回答以下问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com