
分析 用惰性电极电解氯化钠溶液生成氢氧化钠、氢气和氯气;阳极上发生氧化反应,氯离子失去电子生成氯气,氯气具有强的氧化性,能够使湿润的淀粉碘化钾试纸放在排气口变蓝,据此解答.
解答 解:电解饱和食盐水生成氢氧化钠和氢气、氯气,电解方程式:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
与电源正极相连的电极是阳极,阳极上发生氧化反应,氯离子失去电子生成氯气,氯气具有强的氧化性,能够使湿润的淀粉碘化钾试纸放在排气口变蓝,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑; Cl2;湿润的淀粉碘化钾试纸放在排气口变蓝.
点评 本题考查了电解饱和食盐水,明确电解池工作原理,熟悉氯气性质即可解答,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 由同种元素组成的物质一定属于纯净物 | |
| B. | NaHCO3在水中电离:NaHCO3═Na++H++CO32- | |
| C. | 含金属元素的离子不一定都是阳离子 | |
| D. | 具有相同质子数的微粒都属于同种元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
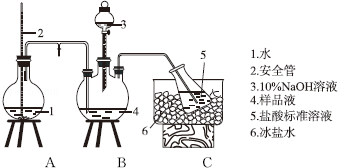
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
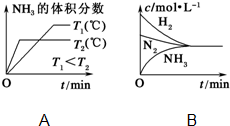 已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:
已知工业上合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol,回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| $\frac{浓度}{(mol•{L}^{_1})}$ | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.
实验室需要0.1mol/LNaOH溶液450mL和0.5mol/L的硫酸溶液500mL.根据这两种溶液的配制情况回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实 验 操 作 及 现 象 | 实 验 结 论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO${\;}_{4}^{2-}$ |
| B | 向某溶液中加入盐酸,能产生使澄清石灰水变浑浊的气体 | 该溶液中一定含CO32- |
| C | 向某溶液中加入适量NaOH稀溶液,将湿润的红色石蕊试纸放在试管口,试纸不变色 | 该溶液中一定不含NH4+ |
| D | 用干燥洁净的铂丝蘸取某溶液放在酒精灯火焰上灼烧,透过蓝色钴玻璃观察到火焰呈紫色 | 该溶液一定含有钾元素,可能含有钠元素 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0mol/L | B. | 1.0mol/L | C. | 0.5mol/L | D. | 0.2mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com