

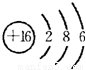
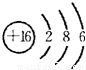
 ;戊为过氧化钠,由钠离子与过氧根离子构成,电子式为
;戊为过氧化钠,由钠离子与过氧根离子构成,电子式为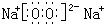 ,
, ;
;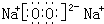 ;
; HCO3-+OH-,使溶液呈碱性,
HCO3-+OH-,使溶液呈碱性, HCO3-+OH-,使溶液呈碱性;
HCO3-+OH-,使溶液呈碱性;

科目:高中化学 来源: 题型:





 HCO3-+OH-,使溶液呈碱性
HCO3-+OH-,使溶液呈碱性 HCO3-+OH-,使溶液呈碱性
HCO3-+OH-,使溶液呈碱性查看答案和解析>>
科目:高中化学 来源:2010届云南省高三高考冲刺卷(八)理科综合化学试题 题型:填空题
(15分)有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半,A元素最外层电子数比B多一个;甲、乙、丙是三种含氧酸的钠盐,甲中含B元素,乙中含C元素,丙中含A元素,甲、丙溶液pH>7,乙溶液pH<7,丁为气体,戊为淡黄色固体,甲、乙、丙、丁、戊、己六种物质之间的相互反应关系如下图:
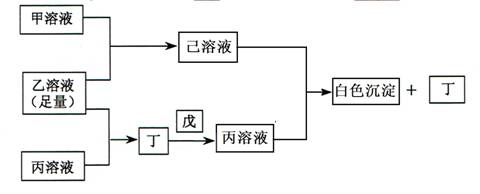
请回答:
(1)写出C元素的原子结构示意图__________________________。
写出丁和戊的电子式:__________________________。
(2)用有关化学用语解释乙溶液呈酸性的原因:__________________________。
丙溶液呈碱性的原因:_______________________________________。
(3)写出有关反应的离子方程式:_____________________________。
①乙溶液+丙溶液→丁:_____________________________________________。
②己溶液+丙溶液→丁:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半。A元素原子最外层电子数比B元素原子最外层电子数多1个。甲是B元素含氧酸的钠盐。乙是C元素最高价含氧酸的酸式钠盐。丙是A元素含氧酸的钠盐(正盐)。甲、丙溶液pH>7,乙溶液pH<7,丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间相互反应关系如下:
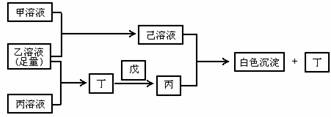
试回答:
(1)C元素原子结构示意图为: ;丁的结构式为: ;戊的电子式为: ;
(2)用有关离子方程式(或电离方程式)解释:
①乙溶液显酸性的原因是:_______________________________________;
②丙溶液呈碱性的原因是:_______________________________________;
(3)写出有关反应的离子方程式:
①乙溶液 + 丙溶液: ;
②己溶液 + 丙溶液: ;
查看答案和解析>>
科目:高中化学 来源: 题型:
有常见A、B、C三种短周期元素,它们的原子序数逐渐增大,B元素原子最外层电子数是C元素原子最外层电子数的一半。A元素原子最外层电子数比B元素原子最外层电子数多1个。甲是B元素含氧酸的钠盐。乙是C元素最高价含氧酸的酸式钠盐。丙是A元素含氧酸的钠盐(正盐)。甲、丙溶液pH>7,乙溶液pH<7,丁为气体,戊为淡黄色固体。甲、乙、丙、丁、戊、己六种物质之间相互反应关系如下:
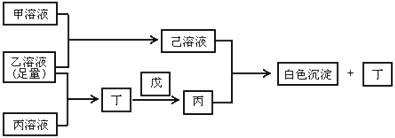
试回答:
(1)C元素原子结构示意图为: ;丁的结构式为: ;戊的电子式为: ;
(2)用有关离子方程式(或电离方程式)解释:
①乙溶液显酸性的原因是:_______________________________________;
②丙溶液呈碱性的原因是:_______________________________________;
(3)写出有关反应的离子方程式:
①乙溶液 + 丙溶液: ;
②己溶液 + 丙溶液: ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com