
| A. | 容量瓶:500mL、250mL各一个;CuSO4:共120g | |
| B. | 容量瓶:750mL;CuSO4:120g | |
| C. | 容量瓶:1000mL;CuSO4•5H2O:160g | |
| D. | 容量瓶:1000mL;CuSO4:160g |
分析 一定容积规格的容量瓶只能配制相应体积的溶液,由于没有750ml的容量瓶,选择大于750ml相近规格的容量瓶;
根据化学式可知硫酸铜的物质的量等于硫酸铜晶体的物质的量,根据m=cnM计算所需胆矾的质量.
解答 解:由于没有750ml的容量瓶,选择大于750ml相近规格的容量瓶,所以应选择1000ml规格容量瓶,
根据化学式可知硫酸铜的物质的量等于硫酸铜晶体的物质的量,所以需要胆矾的质量为:
1L×1mol/L×160g/mol=160.0g.
故选D.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,注意没有750ml的容量瓶,溶液实际应配制1000ml,所用固体的质量应按配制1000mL溶液计算所用的量称量.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 苏打 | 水 | 氨气 |
| B | 氢氧化钡 | 氢氧化铁胶体 | 硫酸钡 | 氨水 | 乙醇 |
| C | 明矾 | 水煤气 | 硫酸 | 醋酸 | 干冰 |
| D | 石灰石 | 水玻璃 | 氯化钙 | 氢氧化铝 | 碳酸钙 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
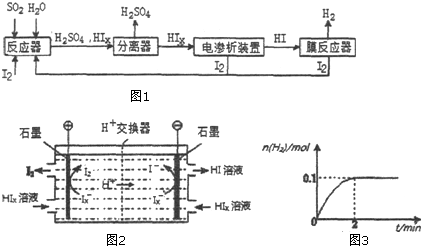
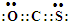 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L1) | NaOH物质的量浓度(mol•Lˉ1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.1 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com