
【题目】为了验证卤素单质氧化性的相对强弱,某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)

实验过程:
Ⅰ.打开弹簧夹,打开活塞 a,滴加浓盐酸
Ⅱ.当 B 和 C 中的溶液都变为黄色时,夹紧弹簧夹
Ⅲ.当 B 中溶液由黄色变为棕红色时,关闭活塞 a
Ⅳ.…
(1)A 中反应的化学方程式为:____KMnO4+_____HCl(浓)═____ KCl+____MnCl2+____Cl2↑+____H2O,则氧化性 KMnO4________Cl2(填“>”“<”或“=”).
(2)验证氯气的氧化性强于碘的实验现象是__________
(3)过程Ⅲ的实验目的是__________
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是__________。
(5)浸有 NaOH溶液的棉花团的作用是__________。此处发生 的化学方程式是__________。
(6)氰(CN)2、硫氰(SCN)2的化学性质和卤素很相似,化学上称为“类卤素”,它们阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-。试写出:
a.(CN)2 与 KOH 反应的化学方程式__________;
b.在 NaBr 和 KSCN 的混合溶液中加入(CN)2 的离子方程式__________。
【答案】2 16 2 2 5 8 > 湿润的淀粉KI试纸变蓝 确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰 打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色 处理尾气,防止污染环境 2NaOH + Cl2 = NaCl + NaClO +H2O 2KOH + (CN)2 = KCN + KCNO +H2O (CN)2 + 2SCN- = (SCN)2+ 2CN-
【解析】
A中高锰酸钾与浓盐酸反应得到氯气,氯气将碘离子氧化为碘单质,淀粉遇碘显蓝色可以证明碘单质的生成,B、C中氯气将溴离子氧化为黄色的溴单质,氯气将C中的溴离子完全氧化为溴单质,注意排除氯气的干扰,再将C加入D,溴单质将D中碘离子氧化得到碘单质,振荡试管发生萃取,四氯化碳中显示紫红色;根据Cl2与KOH反应类比(CN)2与KOH反应,根据还原性:CN- < SCN-,则氧化性为Br2 > (CN)2 > (SCN)2,得出KSCN和(CN)2反应。
(1)根据化合价升降相等,得出A 中反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,氧化剂氧化性大于氧化产物氧化性,因此氧化性 KMnO4>Cl2,故答案为:2;16;2;2;5;8;>。
(2) 氯气遇到淀粉KI试纸时,发生反应2KI+Cl2=2KCl+I2,生成的碘单质可以使湿润的淀粉试纸变蓝,由此证明氯气的氧化性强于碘,故答案为:湿润的淀粉KI试纸变蓝。
(3) 氯气也能氧化溴离子,验证溴置换碘时应排除氯气的干扰,故过程Ⅲ实验的目的是确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰;故答案为:确认C的黄色溶液中无Cl2,排除Cl2对溴置换碘实验的干扰。
(4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色;故答案为:打开活塞b,将少量C中溶液滴入D中,关闭活塞b,取下D,振荡,静置后CCl4层溶液变为紫红色。
(5)浸有 NaOH溶液的棉花团的作用是处理尾气,防止污染环境。此处发生的化学方程式是2NaOH + Cl2 = NaCl + NaClO +H2O;故答案为:处理尾气,防止污染环境;2NaOH + Cl2 = NaCl + NaClO +H2O。
(6)a. 根据阴离子的还原性强弱为:Cl- < Br- < CN- < SCN- < I-,(CN)2与KOH 反应的化学方程式2KOH + (CN)2 = KCN + KCNO +H2O;故答案为:2KOH + (CN)2 = KCN + KCNO +H2O。
b. 还原性:CN- < SCN-,则氧化性为Br2 > (CN)2 > (SCN)2,因此在 NaBr 和 KSCN的混合溶液中加入(CN)2的离子方程式 (CN)2 + 2SCN- = (SCN)2+ 2CN-;故答案为:(CN)2 + 2SCN- = (SCN)2+ 2CN-。


科目:高中化学 来源: 题型:
【题目】轮烷是一种分子机器的“轮子”,轮烷的一种合成原料由C、H、O三种元素组成,其球棍模型如图所示,下列对该化合物的说法中,正确的是( )
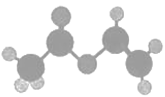
A. 名称是乙醚
B. 只含有一种官能团
C. 链状同分异构体中,属于羧酸的有3种
D. 既能发生加聚反应,又能发生缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中依据热化学方程式得到的对应结论正确的是
热化学方程式 | 结论 | |
A | 稀溶液中:H+(aq)+OH-(aq)=H2O (l) △H=-57.3kJ.mol-1 | 将稀硫酸与氢氧化钡溶液混合后,若有1molH2O 生成,则放出的能量为57.3kJ |
B | Sn(s,灰) | 锡制品在炎热的夏天更容易损坏 |
C | P4(s,白磷)=4P(s,红磷) △H=-29.2kJ.mol-1 | 常温下红磷比白磷更稳定 |
D | C3H8(g)+5O2(g)=3CO2 (g)+4H2O(g) △H=-2043.9kJ.mol-1 | C3H8的燃烧热△H=-2043.9kJ.mol-1 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分下图中X是无支链的、具有果香味的合成香料,可用于调配多种果香型香精。已知
D在标准状况下的密度为1.25 g/L,其产量可以用来衡量一个国家石油化工发展水平。E是生活
中常见的一种有机物。各物质间转化关系如下:
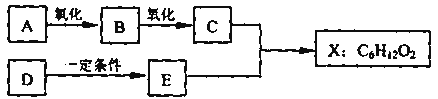
请回答下列问题。
(1)A的名称是________________________。
(2)B中所含的官能团是________________。
(3)C+E![]() X的化学反应类型是___________________反应。
X的化学反应类型是___________________反应。
(4)写出任意两种与A具有相同官能团的A的同分异构体的结构简式 (不含A):_________。
(5)X与氢氧化钠溶液反应的化学方程式是______________________________。
(6)以D为原料生产一种常见塑料的化学方程式是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)12.4g Na2X含有0.4mol Na+,Na2X的摩尔质量为_____,X的相对原子质量为_____。
(2)相同状况下,一定体积的气态氢化物H2X的质量是等体积NH3的2倍.则X的相对原子质量为_____。
(3)0.05mol 的硫酸钠中含有_____个氧原子;与_____g NaCl中所含有的Na+数目相同.
(4)气态化合物A的化学式可以表示为OxFy,已知同温同压下10mLA受热完全分解生成15mLO2和10mL F2,则A的化学式为_____。
(5)0.5L 0.5mol/L FeCl3溶液中的Cl﹣的物质的量浓度为_____。
(6)质量分数为98%,密度为1.84g.cm﹣3的某浓硫酸,溶质的物质的量浓度为_____。
(7)a个X原子的总质量为b g,则X的相对原子质量可表示为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:

(1)在装置A和装置B中都用到玻璃棒,装置A中玻璃棒的作用是__,装置B中玻璃棒的作用是__,防止蒸发皿内溶液因局部过热而溅出。
(2)装置C中①的名称是__,①中加入沸石的作用是__,冷却水的方向是__。
(3)从氯化钠溶液中得到氯化钠固体,选择装置__(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置__。检验自来水中Cl-是否除净的方法:取少量锥形瓶中的水于洁净试管中,滴加__,不产生白色沉淀表明Cl已除净。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2,黄绿色易溶于水的气体)是一种安全稳定、高效低毒的消毒剂。工业上通过惰性电极电解氯化铵和盐酸的方法制备,其原理如图所示:
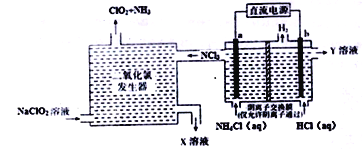
下列说法不正确的是
A. b电极接电源的负极,在b极区流出的Y溶液是稀盐酸
B. 二氧化氯发生器中排出的X溶液中溶质主要为NaCl和NaOH
C. 电解过程中二氧化氯发生器中产生2.24L(标准状况)NH3,则b极产生0.6gH2
D. 电解池a极的电极反应式为NH4+-6e-+4OH-+3Cl-=NCl3+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定量的氯气与消石灰反应,将反应完全后所得的混合物干燥即可制成漂白粉。现有氯气3.36升(![]() ),消石灰15g,请计算由此制得的漂白粉中有效成分的质量百分含量(假设反应物均无其它损耗;计算结果保留一位小数)_________________
),消石灰15g,请计算由此制得的漂白粉中有效成分的质量百分含量(假设反应物均无其它损耗;计算结果保留一位小数)_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com