
【题目】工业上利用氧化铝基废催化剂(主要成分为Al2O3,还含有少量Pd)回收Al2(SO4)3及Pd的流程如下:

(1)Al2(SO4)3溶液蒸干灼烧后所得物质的化学名称是___________。
(2)焙烧时Al2O3与(NH4)2SO4反应的化学方程式为___________。
水浸与中和步骤得到溶液的操作方法是___________。
(3)浸液Y中含Pd元素的溶质是___________ (填化学式)。
(4)“热还原”中每生成1molPd生成的气体的物质的量为___________ (已知热还原得到的固体只有Pd)。
(5)Pd是优良的储氢金属,其储氢原理为2Pd(s)+xH2(g)==2PdHx(s),其中x的最大值为0.8。已知: Pd的密度为12g·cm-3, 则10.6cm3Pd能储存标准状况下H2的最大体积为___________L。
(6)铝的阳极氧化法是将铝作为阳极,置于硫酸等电解液中,加入α-羟基丙酸、丙三醇后进行电解,可观察到铝的表面会形成一层致密的氧化膜。
①写出电解时阳极的电极反应式:______________________ 。
②电解过程中α-羟基丙酸、丙三醇的作用可能是______________________。
【答案】硫酸铝 3(NH4)2SO4+Al2O3高温Al2(SO4)3+6NH3↑+3H2O↑ 过滤 H2PdCl6 8mol 10.752 2Al+3H2O-6e-==Al2O3+6H+ 抑制氧化膜的溶解(或使形成的氧化膜更致密等其他合理答案)
【解析】
废催化剂(主要成分为Al2O3,少量Pd),硫酸铵焙烧得到气体X为氨气,产物水浸过滤得到硫酸铝溶液,滤渣Pd加入浓硝酸和浓盐酸酸浸生成二氧化氮,浸液Y是Pd溶于王水生成,Pd+6HCl+4HNO3![]() H2PdCl6+4NO2↑+4H2O,Y为H2PdCl6,通入氨气中和过滤得到滤渣(NH4)2PdCl6,被氢气还原得到Pd。
H2PdCl6+4NO2↑+4H2O,Y为H2PdCl6,通入氨气中和过滤得到滤渣(NH4)2PdCl6,被氢气还原得到Pd。
(1)Al2(SO4)3溶液中水解生成氢氧化铝和硫酸,加热蒸发,硫酸是难挥发性酸,蒸出的为水,得到硫酸铝固体;
答案: 硫酸铝
(2)从流程中得知,反应物为(NH4)2SO4和Al2O3,生成物包括NH3和Al2(SO4)3,不难推出还有另一个生成物水,注意条件高温不要漏了;水浸后分离出滤渣和溶液,所以操作为过滤;
答案:3(NH4)2SO4+Al2O3![]() Al2(SO4)3+6NH3↑+3H2O↑ 过滤
Al2(SO4)3+6NH3↑+3H2O↑ 过滤
(3)氨气中和后生成滤液(NH4)2SO4,所以往前推理Y中含Pd的溶质为H2PdCl6;
答案:H2PdCl6
(4)(NH4)2PtCl6+2H2![]() Pt+2NH3↑+6HCl↑,热还原得Pd,生成1molPd,则还有2mol氨气和6molHCl,故气体物质的量为8mol;
Pt+2NH3↑+6HCl↑,热还原得Pd,生成1molPd,则还有2mol氨气和6molHCl,故气体物质的量为8mol;
答案:8mol
(5)本题利用化学计量知识计算,m=ρV,n=m/M,得n(Pd)=1.2mol,x最大值为0.8,则令x=0.8,参与反应氢气为0.48mol,故标准状况下气体体积为10.752L。
答案:10.752
(6)①阳极反应方程式为铝失去电子,生成氧化膜氧化铝,反应式为2Al+3H2O-6e-==Al2O3+6H+;
答案:2Al+3H2O-6e-==Al2O3+6H+
②因为实验目的是观察氧化膜的形成,所以添加物的目的要从保持氧化膜的角度考虑即可,答案可以是抑制氧化膜的溶解(或使形成的氧化膜更致密等其他合理答案);
答案:抑制氧化膜的溶解(或使形成的氧化膜更致密等其他合理答案)


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】2019 年是“国际化学元素周期表年”。 1869 年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。下列说法中错误的是
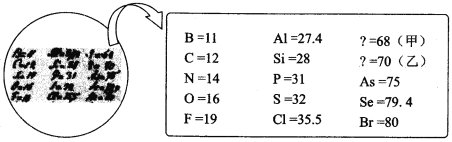
A. 甲位于现行元素周期表第四周期第ⅢA 族B. 原子半径比较:甲>乙> Si
C. 乙的简单气态氢化物的稳定性强于CH4D. 推测乙的单质可以用作半导体材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化亚铜(Cu2O)是一种用途广泛的光电材料,某工厂以硫化铜矿石(含 CuFeS2、Cu2S等)为原料制取Cu2O的工艺流程如下:

常温下几种物质开始形成沉淀与完全沉淀时的pH如下表

(1)炉气中的有害气体成分是___________,Cu2S与O2反应时,氧化剂与还原剂的物质的量之比为___________。
(2)若试剂X是H2O2溶液,写出相应反应的离子方程式:______________________。当试剂X是___________时,更有利于降低生产成本。
(3)加入试剂Y调pH时,pH的调控范围是______________________。
(4)写出用N2H4制备Cu2O的化学方程式:______________________,操作X包括___________、洗涤、烘干,其中烘干时要隔绝空气,其目的是___________。
(5)以铜与石墨作电极,电解浓的强碱性溶液可制得纳米级Cu2O,写出阳极上生成Cu2O的电极反应式:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了酸性高锰酸钾与草酸的反应,记录以下实验数据:
实验编号 | 实验温度 | 试管中所加试剂及其用量 / mL | 溶液褪至无色所需时间/ min | |||
0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请写出该反应的离子方程式__________________________________________,当该反应以表中数据反应完全时转移电子数为_______________NA
(2)V1 ______
(3)根据上表中的实验①、②数据,可以得到的结论是_____。
(4)探究温度对化学反应速率的影响,应选择_____(填实验编号)
(5)该小组同学根据经验绘制了 n (Mn 2+ )随时间变化的趋势如图 1 所示,但有同学查阅已有的实验资料发现,该实验过程中 n (Mn 2+ ) 随时间变化的实际趋势如图 2 所示。

该小组同学根据图 2 所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再加入某种固体 | 溶液褪至无色所需时间 / min | |||
④ | 25 | 0.6mol/L H2C2O4 溶液 | H2O | 3mol/L H2SO4 稀溶液 | 0.05mol/L KMnO4 溶液 | ||
2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t | ||
①该小组同学提出的假设是_____。
②若该小组同学提出的假设成立,应观察到_________________________________现象。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗结肠炎药物Y结构如图所示,以下说法错误的是

A. 该有机物既能和酸反应又能和碱反应
B. 1mol该有机物可以和2molNaOH发生反应
C. 该有机物可以发生缩聚反应
D. 该有机物不能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的构型判断错误的是
A. 甲烷是正四面体结构,烷烃的碳原子呈直线形
B. 乙烯是平面结构,四个氢原子和二个碳原子共面
C. 苯分子中碳原子采用sp2杂化,得到平面正六边形结构
D. 氨气分子的空间构型为三角锥形,氮原子杂化方式为SP3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关性质的比较中,不正确的是
A. 硬度由大到小:金刚石>碳化硅>晶体硅
B. 晶格能:NaBr<NaCl<MgO
C. 键的极性:N-H<O-H<F-H
D. 熔点:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铍及其化合物的应用正日益被重视。
(l)最重要的含铍矿物是绿柱石,含2%铬(Cr)的绿柱石即为祖母绿。基态Cr原子价电子的轨道表示式为______________________________。
(2)铍与相邻主族的铝元素性质相似。下列有关铍和铝的叙述正确的有_____(填标号)。
A.都属于p区主族元素 B.电负性都比镁大
C.第一电离能都比镁大 D.都能与氢氧化钠溶液反应
(3)铍、镁晶体都是由金属原子密置层在三维空间堆积而成(最密堆积)。铍的熔点比镁的熔点高,原因是_____________________________________________________。
(4)氯化铍在气态时存在BeC12分子(a)和二聚分子(BeCl2)2(b),固态时则具有如图所示的链状结构(c)。

①a属于_____“极性”或“非极性”)分子。
②b中Be原子的杂化方式相同,且所有原子都在同一平面上。b 的结构式为________(标出配位键)。
③c中Be原子的杂化方式为_____。
④氯化铍晶体中存在的作用力有_____(填标号)。
A.范德华力 B.σ键 C.极性键 D.非极性键 E.离子键
(5)BeO立方晶胞如图所示。

①BeO晶体中,O2﹣的配位数为_____。
②若BeO晶体的密度为dg/cm3,BeO的摩尔质量为Mg·mol-1,阿伏伽德罗常数为NA,则晶胞参数a=_______________ cm (列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 配制一定物质的量浓度的NaOH溶液时,NaOH固体溶解后未恢复到室温就转移、定容,所配制的溶液浓度偏大
B. 用广泛pH试纸测得氯水的pH为3
C. 用托盘天平称取5.86g食盐
D. 用细铁丝放在酒精灯火焰上灼烧至无色,然后蘸取少量待测液,透过蓝色钴玻璃观察火焰呈紫色,说明待测液中一定含有K+,没有Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com