
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量的O2和CO2所含氧原子数均为2NA | |
| B. | 标准状况下,2.24 L一氯甲烷中含有氢原子数目为0.3NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 6.8 g熔融的KHSO4中含有0.1 NA个阳离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
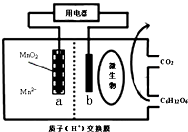
| A. | H+向左移动 | |
| B. | 电子由a极沿导线流向b极 | |
| C. | b极电极反应式为:C6H12O6-24e-+6H2O=6CO2+24H+ | |
| D. | 当电路中转移0.2mole-时,a极质量减少8.7g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 实验结论 |
| A | 将SO2通入Ba(NO3)2溶液中,溶液变浑浊 | 生成BaSO3沉淀 |
| B | 点燃CO还原Fe2O3后的尾气,气体未能燃烧 | CO已完全反应 |
| C | 向某溶液中加入2滴KSCN溶液,溶液不显红色,再向溶液中加入几滴新制氯水,溶液变为红色 | 该溶液中一定含有Fe2+ |
| D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | b<2 | B. | X只能位于第三周期 | ||
| C. | a+n-b+m=10或16 | D. | Y不可能位于第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
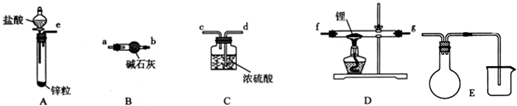
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
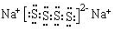 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com