
【题目】电离度表示电解质的相对强弱,电离度的定义:
α=(已电离的电解质分子数/溶液中原有电解质的总分子数)×100%。
已知25℃时几种物质(微粒)的电离度(溶液浓度均为0.1 mol·L-1)如下表:
编号 | 物质(微粒) | 电离度α |
A | 硫酸溶液(第一步完全电离):第二步HSO4- | 10% |
B | 硫酸氢钠溶液:HSO4- | 29% |
C | 醋酸:CH3COOH | 1.33% |
D | 盐酸:HCl=H++Cl- | 100% |
(1)25℃时,0.1 mol·L-1上述几种溶液中,c(H+)从小到大的顺序是 (填序号);
(2)25℃时,0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO4-的电离度,其原因是 。
(3)醋酸的电离平衡常数K的表达式是 ,醋酸的电离平衡常数K与电离度α的关系式为:K= (用含α的代数式表示)
【答案】(1)CBDA (2)H2SO4=HSO4-+H+ ;硫酸第一步电离的H+对第二步电离有抑制作用,HSO4-![]() H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4- 的电离度。
H++SO42-使平衡向左移动,即电离度小于硫酸氢钠溶液中HSO4- 的电离度。
(3)k=c(CH3COO-)×C(H+)/C(CH3COOH) K=0.1×α2/(1-α)
【解析】
试题分析:弱酸存在电离平衡,电离程度的大小可以用电离度来衡量,电离度越大,相对来说,酸性或碱性越强;0.1 mol·L-1上述几种溶液中,c(H+)从小到大的顺序是CH3COOH、 HSO4-、 HCl H2SO4 ;0.1 mol·L-1硫酸溶液中HSO4-的电离度小于相同温度下0.1 mol·L-1硫酸氢钠溶液中HSO4-的电离度,其原因是硫酸第一步完全电离出的H+抑制了HSO4-![]() H++SO42-的第二步电离;
H++SO42-的第二步电离;
(3)CH3COOH=CH3COO_+H+
0.1 0 0
X X X
0.1- X X X
① 电离平衡常数K= X2/ (0.1- X), ② 电离度α=X/0.1,联合①②,得出K与α的关系式。


科目:高中化学 来源: 题型:
【题目】选择下列实验方法分离物质,将分离方法的字母序号填在横线上。
A.过滤法 B.分液法
C.蒸馏法 D.结晶法
①分离水和豆油的混合物;
②从含有硝酸钾和少量氯化钾的混合溶液中获得硝酸钾;
③分离饱和食盐水和沙子的混合物;
④分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃),已知四氯化碳和甲苯互溶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学 — 有机化学基础】3-对甲苯丙烯酸甲酯(E)是一种用于合成抗血栓药的中间体,其合成路线如下:
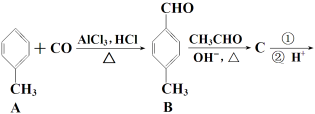
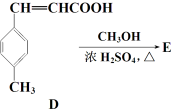
已知:HCHO+CH3CHO![]() CH2===CHCHO+H2O
CH2===CHCHO+H2O
(1) A的核磁共振氢谱图显示峰的面积比为_________;A→B新生成的官能团名称为 。
(2) B的同系物G(C9H10O)的同分异构体有多种,其中满足下列条件的同分异构体数目有 种(不考虑立体异构)① 遇FeCl3溶液呈紫色;②苯环上有两个取代基。
(3) C的结构简式为___________;D→E的反应类型为___________。
(4) 过程①选用的试剂可选用下列中的___________。
a.溴水 b. 银氨溶液 c.酸性KMnO4溶液 d.新制Cu(OH)2悬浊液
(5) ![]() 是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________。
是E的一种同分异构体,该物质与足量NaOH溶液共热的化学方程式为__________________________。
(6) E在一定条件下可以合成高聚物F,F的结构简式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答氯碱工业的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k=__________
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②盐酸 ③BaCl2,
这三种试剂添加的合理顺序是______________(填序号)
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
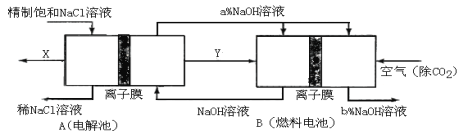
①图中X、Y分别是_____________、_____________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小 。
②分别写出燃料电池B中正极、负极上发生的电极反应: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知8838Sr位于IIA族,下列有关Sr的说法不正确的是( )
A.原子半径:Sr>Ca
B.最高化合价为+2
C.8838Sr的中子数为38
D.氢氧化物为强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—物质结构与性质】如右图是元素周期表的一部分。已知R的核电荷数小于36,气态氢化物沸点:MHn>YHn。
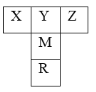
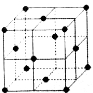
(1)表中五种元素第一电离能最大的是 (填元素符号),Y的最简单氢化物分子的空间构型为 ,基态R原子中有 个未成对电子。
(2)Y的最高价氧化物熔点比M的最高价氧化物熔点低,原因是 ,YZ-中σ键与π键的个数比为 。
(3)YO32-中Y原子的杂化方式是 ,写出一种与YO32-互为等电子体的粒子 (用化学符号表示)。
(4)Z的一种常见氢化物能与硫酸铜反应生成配合物。请用结构简式表示该配合物中的阳离子: 。
(5)如图为某金属单质的面心立方晶胞结构示意图,该晶体中配位数是 ;测得此晶体的密度为2.7g.cm-3,晶胞的边长为0.405nm,则此金属原子的相对原子质量为 (结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在高空中有一层臭氧层,它吸收太阳了太阳光中绝大部分紫外线,使地球上的生物免受紫外线伤害,臭氧的化学式是O3,它是一种
A. 混合物 B. 氧化物 C. 单质 D. 化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用pH试纸测定某无色溶液的pH时,规范的操作是( )
A.将pH试纸放入溶液中观察其颜色变化,跟标准比色卡比较
B.将溶液倒在pH试纸上,跟标准比色卡比较
C.用干燥的洁净玻璃棒蘸取溶液,滴在pH试纸上,跟标准比色卡比较
D.在试管内放入少量溶液,煮沸,把pH试纸放在管口,观察颜色,跟标准比色卡比较
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用铜电极电解硝酸银溶液:4Ag++2H2O![]() 4Ag+O2↑+4H+
4Ag+O2↑+4H+
B.FeS中加入足量稀硝酸:FeS+2H+=Fe2++H2↑
C.石灰石溶于醋酸溶液中:CaCO3+2H+=Ca2++H2O+CO2↑
D.澄清石灰水中通入过量的CO2:CO2+OH﹣=HCO3﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com