
【题目】Ⅰ、为测定金属钠样品(表面有 Na2O)中钠单质的质量分数,设计了如下实验(反应装置如图所示):

①称量 A、B 的总质量
②称取一定质量的钠样品
③将钠样品投入锥形瓶中,迅速塞紧带 U 形干燥管(内含无水 CaCl2 干燥 剂)的橡皮塞 。有关数据是:称取的金属钠样品质量为 a g,A、B 反应前总质量为 b g,反应后 A、B 的总质量为 c g。 请根据题意回答下列问题:
(1)A 中钠和水反应过程可看到钠熔成闪亮的小球,产生这一现象原因是:_____________
(2)用 a、b、c 表示的钠单质的质量分数为_______________
(3)如果没有 B 装置对实验结果有何影响___________。(填“偏大”或“偏小”“不影响”)
Ⅱ、现用金属钠和空气制备纯度较高的 Na2O2,可利用的装置如下图。回答下列问题:


(4)上述装置Ⅳ中盛放的试剂是______,为完成实验应将装置Ⅳ接在_____(填写字母号)。
A.I 之前 B. I 和 II 之间 C. II 和 III 之间 D.III 之后
(5)点燃酒精灯后,观察到装置 II 中的现象为_____。
Ⅲ、现用制得纯度较高的 Na2O2进行相关实验。回答下列问题:
(6)用脱脂棉包住Na2O2粉末,置于石棉网上,通过细管向脱脂棉中吹CO2,脱脂棉_______(填“能”或“不能”)燃烧起来。
(7)盛有0.78 g Na2O2、1.68g NaHCO3的固体混合物放在密闭容器中加热,最后固体质量为_________g.
【答案】该反应为放热,钠的熔点低 23(a+b-c)/a 偏大 浓硫酸 B 钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体 能 2.12
【解析】
Ⅰ. (1)钠和水剧烈反应,放出大量的热,由于钠的熔点较低,所以反应过程钠熔成闪亮的小球;
(2)根据钠与水反应的方程式为:2Na+2H2O=2Na0H+H2↑进行相关计算;
(3)没有B装置,生成的氢气会带走一部分水蒸气,造成浓度偏高,造成c减小;
Ⅱ.(4)要制得较纯的过氧化钠,则Ⅰ为吸二氧化碳,Ⅳ为吸水蒸气,应将Ⅳ接在Ⅰ与Ⅱ之间,并长进短出;
(5)根据钠在氧气中燃烧的现象回答;
Ⅲ、(6)Na2O2能够与二氧化碳气体反应,放出大量的热,并放出氧气,据此进行分析;
(7)根据碳酸氢钠受热易分解,发生的反应为 2NaHCO3=Na2CO3+H2O+CO2↑;根据0.02mol NaHCO3计算出反应生成Na2CO3、生成H2O、生成CO2的量;反应生成的二氧化碳和水蒸气分别与过氧化钠发生反应:2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑;然后根据0.01mol Na2O2恰好与0.01molCO2完全,计算出生成碳酸钠的质量,把2次生成的碳酸钠的质量相加即为最终所得固体质量。
Ⅰ. (1)A 中钠和水剧烈反应,放出大量的热,由于钠的熔点较低,所以反应过程可看到钠熔成闪亮的小球;
综上所述,本题答案是:该反应为放热,钠的熔点低。
(2)设 Na的质量为xg,则钠与水反应生成氢氧化钠和氢气,反应方程式为:2Na+2H2O=2Na0H+H2↑,根据反应关系可知:46/x=2/(a+b-c),则x=23(a+b-c)/ag;
综上所述,本题答案是:23(a+b-c)/a。
(3)没有B装置,生成的氢气会带走一部分水蒸气,造成浓度偏高,造成c减小,使质量分数增大;
综上所述,本题答案是:偏大。
Ⅱ.(4)装置Ⅳ装有浓硫酸,用途为吸收反应气体中的水蒸气,由于水和二氧化碳都能与过氧化钠反应,而要求制得较纯的过氧化钠,则Ⅰ为吸二氧化碳,Ⅳ为吸水蒸气,应将Ⅳ接在Ⅰ与Ⅱ之间,并长进短出,选项B正确;
综上所述,本题答案是:浓硫酸,B。
(5)点燃酒精灯后,钠与氧气反应剧烈反应,观察到装置 II 中的现象为:钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体;
综上所述,本题答案是:钠熔化成光亮的小球,剧烈燃烧产生黄色火焰,生成淡黄色固体。
Ⅲ、(6)Na2O2能够与二氧化碳气体反应,放出大量的热,并放出氧气,达到脱脂棉的着火点,所以脱脂棉能燃烧起来;
综上所述,本题答案是:能。
(7)根据碳酸氢钠受热易分解,发生的反应为 2NaHCO3=Na2CO3+H2O+CO2↑;根据反应关系可知,0.02mol NaHCO3完全反应生成Na2CO3为0.01mol,生成H2O为0.01mol,生成CO2为0.01mol;反应生成的二氧化碳和水蒸气分别与过氧化钠反应:2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑;根据2Na2O2+2CO2===2Na2CO3+O2反应可知,0.01mol CO2参加反应,消耗Na2O2的量为0.01mol,生成Na2CO3的量为0.01mol;由于过氧化钠已经反应完全,就没有后续反应发生;因此所得固体为碳酸钠,质量为(0.01+0.01)×106=2.12g;
综上所述,本题答案是:2.12。


科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)已知CH4和S的燃烧热分别为a kJ/mol 和b kJ/mol。在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2 和液态水。反应的热化学方程式为______________。(△H用含a、b的代数式表示)
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2 所示:

①分析可知X为_______________(写化学式),0~t1时间段的反应温度为_______________,0~t1时间段用SO2表示的化学反应速率为______________________;
②总反应的化学方程式为___________________________________________;
(3)焦炭催化还原SO2生成S2的化学方程式为:2C(s)+2SO2(g)![]() S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
S2(g)+2CO2(g),恒容容器中,lmol/L SO2与足量的焦炭反应,SO2的转化率随温度的变化如图3 所示。
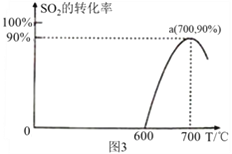
①该反应的ΔH______0(填“>”或“<”);
②700℃的平衡常数为_____________________;
(4)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为___________,25℃时用1mol/L的Na2SO3溶液吸收SO2,当溶液pH=7时,溶液中各离子浓度的大小关系为___________。(已知:H2SO3的电离常数K1=1.3×10-2,K2=6.2×10-8)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,容积为0.5L的密闭容器中,将一定量的二氧化氮和二氧化硫气体混合后发生反应:SO2(g)+NO2(g) ![]() NO(g) +SO3(g)
NO(g) +SO3(g)
在上述平衡体系中通入少量O2,平衡 ________移动(填“向右”、“向左”或“不”); NO的浓度将_______(填“增大”、“减少”或“不变”),c(NO)与c(NO2)之和 ________(填“增大”、“减少”或“不变”)。
(2)高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)===2NO(g)。估算自发进行的最低温度是__________℃。[已知该反应:ΔH=+180.50kJ/mol,ΔS=+247.7 J/(mol·K)]
(3)25 ℃时,将a mol·L-1氨水与0.01 mol·L-1盐酸等体积混合,反应平衡时溶液中c(NH![]() )=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
)=c(Cl-),则溶液显________(填“酸”、“碱”或“中”)性。用含a的代数式表示NH3·H2O的电离常数Kb=________。
(4)用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为________________(用a、b、x表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】R、X、Y、Z是周期表前四周期元素,原子序数依次增大。R是宇宙中含量最多的元素,X、Y、Z三种元素的基态原子内层所有能级均已填满电子。X元素的基态原子的核外电子分布在三个能级上,且每个能级上排布了相同的电子数。Y与X同周期,且Y与X的基态原子中未成对电子数相同。Z的周期数比X的周期数多2,Z的基态原子最外层只有1个电子。回答下列问题:
(1)Z元素的价电子排布式为____________。
(2)R2Y可与Z的正二价离子形成一种复杂离子[Z(R2Y)4]2+,[Z(R2Y)4]2+的几何构型是______;将[Z(R2Y)4]2+与硫酸根形成的盐溶液装入试管中,逐滴加入氨水直至过量,出现的实验现象是______________。
(3)X与R可形成一种化学式为X3R4的不稳定化合物,是一种话性中间体,X3R4分子中3个X原子成直线排列,中间的X原子的杂化轨道类型为_____杂化。当X3R4分子中的4个R原子被其他4个不同种类元素的原子取代时,形成的新分子___(填“具有“或”不具有”)手性。
(4)下列排列方式中,通常条件下Z的晶体的堆积方式是______(填序号)。Z的晶体中,Z原子的配位数为________。
A.ABCABCABC B.ABABABABAB C.ABBAABBA D.ABCCBCABCCBA
(5)Z与F(氟)形成的一种化合物的晶胞结构如右图所示,若晶体密度为ag.cm-3,则Z与F(氟)最近距离为______pm(阿伏加德罗常数用NA表示,列出计算表达式,不用化简,1pm=1.0×10-12m)。
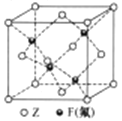
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验误差分析错误的是
A. 用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小
B. 滴定前滴定管内无气泡,终点读数时有气泡,所测体积偏小
C. 用润湿的pH试纸测稀碱溶液的pH,测定值偏小
D. 测定中和反应的反应热时,将碱缓慢倒入酸中,所测温度值偏小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一定物质的量浓度的NaOH溶液100mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,通过计算回答:
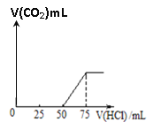
(1)A溶液中的溶质为_________(化学式),其物质的量之比是_______。
(2)通入CO2气体体积__________________(标准状况)。
(3)NaOH溶液的物质的量浓度______________________。
(4)假如通入的CO2气体为112mL, 画出得到溶液逐滴缓慢加入0.1mol/L的HCl溶液体积,与产生的CO2气体体积(标准状况)的关系图________________。(应体现关键点的数据)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系。该溶液的成分可能是
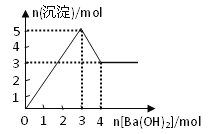
A. MgSO4 B. KAl(SO4)2 C. Al2(SO4)3 D. NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验能得出相应结论的是
选项 | 实验 | 结论 |
A | 常温下,测得0.1mol/LNaA溶液的pH小于0.1mol/L Na2CO3溶液的pH | 酸性:HA>H2CO3 |
B | 向含有淀粉的FeI2溶液中加入足量溴水,溶液变蓝色 | 还原性:I->Fe2+ |
C | 向饱和FeSO4溶液中加入CuS固体,测得溶液中c(Fe2+)不变 | Ksp(CuS)<Ksp(FeS) |
D | 向氨水中滴加少量AgNO3溶液,无沉淀生成 | Ag+与NH3·H2O能大量共存 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1 mol·L-1 FeCl3溶液与0.01 mol·L-1 KSCN溶液等体积混合,发生如下反应:FeCl3+3KSCN![]() Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
Fe(SCN)3+3KCl,所得溶液显红色,改变下列条件,能使溶液颜色变浅的是
A. 向溶液中加入少量KCl晶体 B. 向溶液中加入一定量KCl溶液
C. 向溶液中加入少量AgNO3固体 D. 向溶液中滴加几滴1 mol·L-1 FeCl3溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com