

| ��� | ʵ��Ŀ�� | ̼��/g | ����/g | ����/% |
| �� | Ϊ����ʵ�������� | 0.5 | 2.5 | 90.0 |
| �� | �� | 0.5 | 2.5 | 36.0 |
| �� | ̼��������Ӱ�� | 0.2 | �� | 90.0 |
���� ��1�����ݶԱ������б�֤������Ψһ�Խ��н��
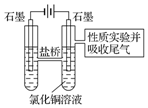
��2���������ⸯʴ��������ʴ��������ƿ��ѹǿ�ı仯�жϸ����ĸ�ʴ���ͣ����ݸ����ĸ�ʴ���ͼ�ԭ���������ת�Ƶķ���̼�۱��������õ������������������ӣ�������ԭ��Ӧ��
��3��ͼ2��0-t1ʱѹǿ������Ƿ��������ⸯʴʹ�������������߷�Ӧ����ʹ�¶����ߣ���ƿ�������������
��4���������������������ɵⵥ�ʣ����ܱ������������ɵ��
��5��������ͭ����Ũ���½��������ӷŵ�ͬʱ��Һ�л��������������ӣ����������Ӻ�ͭ����������ɫ������
��� �⣺��1����Ϊ�������飬���ڢ�̽�������Ũ�ȵ�Ӱ�죬����˴���Ũ�Ȳ�ͬ�⣬��������������ȫ��ͬ������������Ӧ��Ϊ2.5g��
����ֻ��̼�ۺ�����ٲ�ͬ�����Ϊ̽��̼�ۺ�����Ӱ�죬
�ʴ�Ϊ��
| �� | ����Ũ�ȵ�Ӱ�� | |||
| �� | 2.5 |
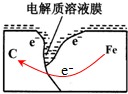 ��̼�缫�����õ����ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+2H2O+4e-=4OH-��
��̼�缫�����õ����ӷ�����ԭ��Ӧ���缫��ӦʽΪ��O2+2H2O+4e-=4OH-�� ��O2+2H2O+4e-=4OH-��
��O2+2H2O+4e-=4OH-������ ������ԭ���ԭ��Ϊ���忼��������̽��ʵ�飬���ݷ�Ӧ����ȷ���������Ϸ����ķ�Ӧ��֪��ԭ��ع���ԭ�����������������������ӻ��������ⵥ�ʣ��Ѷ��еȣ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����

| A�� | ������������Ӧ����1mol�Ȼ������壬��Ӧ����248kJ������ | |
| B�� | 436kJ/mol��ָ�Ͽ�1molH2 �е�H-H����Ҫ�ų�436kJ������ | |
| C�� | 431kJ/mol��ָ����2molHCl�е�H-Cl����Ҫ�ų�431kJ������ | |
| D�� | ������������Ӧ����2mol�Ȼ������壬��Ӧ�ų�183kJ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ѡ�� | a | b | c | �Թܢ������� | 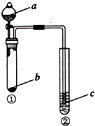 |
| A | NaOH��Һ | Al | ����ˮ | �����ݿɵ�ȼ | |
| B | ϡ���� | ̼��� | NaAlO2��Һ | ���ɰ�ɫ��״�������� | |
| C | ϡ���� | NaHCO3 | BaCl2��Һ | ��Һ����� | |
| D | ˮ | Na2O2 | �ữ��FeSO4��Һ | ��Һ��� |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CO | B�� | NO | C�� | CO2 | D�� | N2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��֪CH3OH��l����ȼ����Ϊ238.6 kJ•mol-1����CH3OH��l��+$\frac{3}{2}$O2��g���TCO2��g��+2H2O��g����H=-238.6 kJ•mol-1 | |
| B�� | ����ˮբ����������������ӵ�����������������ֹ�丯ʴ | |
| C�� | ��ӦH2+Cl2�T2HCl����H��0���Ļ���������Cl2-��2Cl����������H2+Cl-��HCl+H���죩����Cl2+H-��HCl+Cl���죩����Ӧ�ٵĻ��С�ڷ�Ӧ�ڵĻ�� | |
| D�� | һ�������·�ӦN2+3H2?2NH3�ﵽƽ��ʱ��3v����H2��=2v����NH3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ȼúΪȼ�������Լ��ٷ�����SO2���к����ʵ��ŷ���������һ�ִ�ʩ | |
| B�� | 84 ����Һ����Ч�ɷ��� NaClO | |
| C�� | ����ʳƷ���Ӽ���ʳ������彡����һ������ | |
| D�� | ���������У������������������������õ��ǵ��ԭ������ӵ������������������õ� ��ԭ���ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��֪��������H2S��H2CO3�ĵ��볣�����
��֪��������H2S��H2CO3�ĵ��볣�����| Ka1 | Ka2 | |
| H2S | 9.1��10-8 | 1��10-15 |
| H2CO3 | 4.3��10-7 | 5.6��10-11 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 2��1 | B�� | 1��1 | C�� | 1��2 | D�� | 3��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com