
| A. | 从海水中富集镁元素用NaOH沉淀法 | |
| B. | 海水淡化的方法主要有蒸馏法、离子交换法和电渗析法等 | |
| C. | 从海水中提取溴单质的过程中用氯气做还原剂 | |
| D. | 将海带烧成灰,用水浸泡,乙醇萃取可以提取碘单质 |
分析 A、海水中镁离子的浓度较低,需要富集,沉淀镁离子的试剂要经济实惠;
B.海水淡化是除去杂质盐得到淡水,通常有蒸馏法、电渗析法、离子交换法等方法;
C、溴元素由化合态转化为游离态发生氧化还原反应;
D.海带中碘元素为离子,需要加入氧化剂氧化才能得到碘单质,乙醇易溶于水不能做萃取剂;
解答 解:A.从海水中富集镁元素用Ca(OH)2沉淀乙醇易溶于水不能做萃取剂法,氢氧化钠价格较贵,不符合经济效益,故A错误;
B.海水淡化的主要方法有:蒸馏法、电渗析法、离子交换法等,故B正确;
C、溴元素由化合态转化为游离态发生氧化还原反应,反应方程式为:Cl2+2Br-=2Cl-+Br2,所以氯气做氧化剂,故C错误;
D.乙醇易溶于水,水溶液中不能分层不能做萃取剂,故D错误;
故选B.
点评 本题考查了海水资源的综合利用,主要是海水提溴、氯化钠、淡化的方法和原理分析,掌握基础是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:推断题
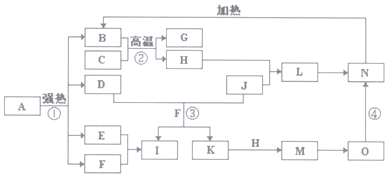
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子(0.1mol/L) | Cu2+ | Fe2+ | Fe3+ | 提供的药品(根据需要选择使用) |
| 氢氧化物开始沉淀pH | 4.7 | 7.0 | 1.9 | Cl2、NaOH溶液、CuO、Cu |
| 氢氧化物沉淀完全pH | 6.7 | 9.0 | 3.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | LiOH、KOH、CsOH的碱性依次增强 | B. | H2O、NH3、PH3的热稳定性依次增强 | ||
| C. | HCl、HBr、HI的还原性依次减弱 | D. | Na、Mg、Al的原子半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3-CH=CH2和  | |
| B. |  和 和  | |
| C. | 甲苯和二甲苯 | |
| D. | CH2=CH-CH=CH2和CH3-CH2-CH2-C≡CH |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 从海水中可提取食盐 | |
| B. | 海水蒸馏可得淡水 | |
| C. | 直接电解海水可得镁 | |
| D. | 从海水中得到淡水的方法有蒸馏法、电渗析法、离子交换法 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )| A. | 正反应吸热,m+n>x+y | B. | 正反应吸热,m+n<x+y | ||
| C. | 正反应放热,m+n<x+y | D. | 正反应放热,m+n<x+y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com