
����Ŀ����֪��ѧ��Ӧ2C(s)��O2(g)![]() 2CO(g)��2CO(g)��O2(g)
2CO(g)��2CO(g)��O2(g)![]() 2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶ�����ͬ�����£�����˵������ȷ����(����)
2CO2(g)���Ƿ��ȷ�Ӧ���ݴ��ƶ�����ͬ�����£�����˵������ȷ����(����)
A.56 g CO��32 g O2�����е�������֮�ʹ���88 g CO2�����е�������
B.12 g C�����е�����һ������28 g CO�����е�����
C.12 g C��32 g O2���������������44 g CO2�����������
D.������������ȵ�̼��ȫȼ�գ�����CO2�ķ�Ӧ������CO�ķ�Ӧ�ų���������
���𰸡�B
��������
���ݷ��ȷ�Ӧ�з�Ӧ��������������������������������������ȫȼ��ʱ�ų����������ڲ���ȫȼ��ʱ���������ݴ������
A. ��2CO(g)+O2(g)![]() 2CO2(g)�Ƿ��ȷ�Ӧ������56 gCO��32 gO2�����е�����������88 gCO2�����е�������������Ӧ����������������������������A��ȷ��
2CO2(g)�Ƿ��ȷ�Ӧ������56 gCO��32 gO2�����е�����������88 gCO2�����е�������������Ӧ����������������������������A��ȷ��
B. ��2C(s)+O2(g)![]() 2CO(g)�Ƿ��ȷ�Ӧ������12 g C��16 g O2�����е�������һ������28 g CO�����е�������������12g C�����е���������28 g CO�����е�������B����
2CO(g)�Ƿ��ȷ�Ӧ������12 g C��16 g O2�����е�������һ������28 g CO�����е�������������12g C�����е���������28 g CO�����е�������B����
C. ��2C(s)+O2(g)![]() 2CO(g)�� 2CO(g)��O2(g)
2CO(g)�� 2CO(g)��O2(g)![]() 2CO2(g)���Ƿ��ȷ�Ӧ������C+O2
2CO2(g)���Ƿ��ȷ�Ӧ������C+O2![]() CO2Ҳ�Ƿ��ȷ�Ӧ������12 g C��32 g O2�����е�������һ������44 g CO2�����е���������C��ȷ��
CO2Ҳ�Ƿ��ȷ�Ӧ������12 g C��32 g O2�����е�������һ������44 g CO2�����е���������C��ȷ��
D. ��������ȫȼ�շų��������Ȳ���ȫȼ�շų������࣬����һ��������̼ȼ�գ�����CO2������COʱ�ų��������࣬D��ȷ��
�ʺ���ѡ����B��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ṥҵβ���е������NO��NO2������Ҫ�Ĵ�����Ⱦ��֮һ�����ð������������ѡ���Դ���ԭ����������Ҫ��Ӧԭ�����£�4NO+4NH3+O2![]() 4N2+6H2O��6NO2+8NH3
4N2+6H2O��6NO2+8NH3![]() 7N2+12H2O��
7N2+12H2O��
ij���᳧�ŷŵ�β���е���������ĺ���Ϊ2490mg/m3���������������״����������NO��NO2���ʵ�����Ϊ4��1����β���е��������백�������ǡ����ȫ��Ӧ��
��1��β���е����������ƽ����Է�������Ϊ___��
��2��β����NO�ĺ���Ϊ___mg/m3��
��3��Ҫ����5m3��β������Ҫ��������������Ϊ___L��
��һ�ִ�����������ķ��������ռ�������գ�����ΪNaNO2��NaNO3��H2O�����к�0.5mol���������β����ǡ�ñ�һ�������25%NaOH��Һ���ܶ�1.28g/cm3����ȫ���ա�
��4��NaOH��Һ�����ʵ���Ũ��Ϊ___mol/L�����Ϊ___mL��
��5����֪��Ӧ����Һ�к���0.35molNaNO2������β����NO��NO2��ƽ����ɼ�ΪNOx��ͨ��������x___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�������Ϊ 10 mL �� 0.1 mol/LNaOH��Һ����μ���0.1mol/LCH3COOH��Һ��������ͼ��ʾ�������й�����Ũ�ȹ�ϵ�ıȽ��У��������
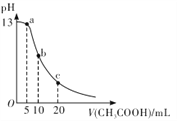
A. a�㴦��c( Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. b�㴦��c(CH3COOH)+c(H+ )=c(OH-)
C. c�㴦��c(CH3COOH)+c(CH3COO-)=2c(Na+)
D. NaOH��Һ��CH3COOH��Һ������Ȼ��ʱ��c( Na+)+c(H+)=c(OH-)+(CH3COO-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨһ���ڿ����е�ij�����ữ��FeSO4��Һ��Fe2+�������İٷ��ʣ�ijͬѧȷ��ȡpH=1������Fe2+��Fe3+��ˮ�⣩��FeSO4��Һ200mL���������BaCl2��Һ����ַ�Ӧ����ˡ�ϴ�ӡ�����õ�����28.0g������ȡͬ����FeSO4��Һ200mL�������м������NaOH��Һ������ʹ���ַ�Ӧ��������ȫ����Ϊ���ɫ���ˡ�ϴ�Ӳ��������ù��壬���յù���8.0g��
��1��д����Ӧ���漰�Ļ�ѧ����ʽ������3����__��__��__
��2��ͨ�����㣬��д�±���
c��H+�� | c��SO42���� | c��Fe2+��Fe3+�� |
__ | __ | __ |
ע��c��Fe2+��Fe3+����ʾFe2+��Fe3+���ܵ����ʵ�����Ũ��
��3������ԭ��Һ��Fe2+�������İٷ���__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25����101 kPa�£�2g����ȼ������Һ̬ˮ���ų�285.8kJ��������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ���ǣ� ��
A. 2H2(g)+O2(g) == 2H2O(1) ��H�� �D285.8kJ��mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) ��H�� +571.6 kJ��mol
C. 2H2(g)+O2(g) == 2H2O(g) ��H�� �D571.6 kJ��mol
D. H2(g)+1/2O2(g) == H2O(1) ��H�� �D285.8kJ��mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
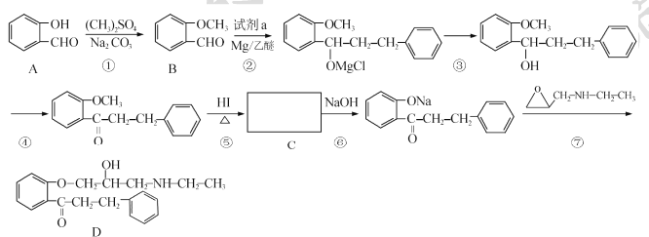
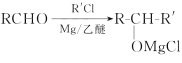
����Ŀ�� ����������ͪ��һ�ָ�Ч��Ч������ʧ��ҩ���ϳɴ�ҩ��ԭ��D���������£�
��֪��
��ش��������⣺
(I)A�Ļ�ѧ����Ϊ____���Լ�a�Ľṹ��ʽΪ____��
(2)C�Ĺ���������Ϊ____________��
(3)��Ӧ�ݵķ�Ӧ����Ϊ____����Ӧ�ٺ͢ݵ�Ŀ��Ϊ_______��
(4)��������������B��ͬ���칹�廹�� ___��(������B)������ijͬ���칹��x�ܷ���ˮ�ⷴӦ���˴Ź���������4����ҷ������Ϊ3:2:2:1����д��x��NaOH��Һ���ȷ�Ӧ�Ļ�ѧ����ʽ____��
���ܷ���������Ӧ �ڱ�������2��ȡ����
(5)��������D��˵��������ȷ����____�����ţ���
a�����ڷ����廯����
b��������ˮ
c�������ֹ�����
d���ɷ���ȡ�����ӳɡ�������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ܱ������з������·�Ӧ��A(g)��3B(g)![]() 2C(g) ��H<0�������������ʡ�ʱ��ͼ�ش��������⡣
2C(g) ��H<0�������������ʡ�ʱ��ͼ�ش��������⡣
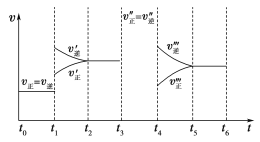
(1)����ʱ�����ı����������ǣ�
t1________��t3________��t4________��
(2)����A�������������ʱ�����________________��
(3)����ͼ����C�����������ȵ�ʱ�����________________��
(4)��Ӧ��������ʱ�����________________��
(5)t0~t1��t3~t4��t5~t6ʱ��ε�ƽ�ⳣ��K0��K3��K5�Ĺ�ϵ________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ȤС��̽����â��Na2SO4��10H2O��CaOΪԭ���Ʊ�Na2CO3��
��1����CaOˮ������â���γ�Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ����Ӧ����ˣ�����Һ��ͨ��CO2�������õ�Na2CO3����Ԫ��ϵ�з�Ӧ�����ӷ���ʽΪ�� SO42��+ Ca(OH)2(s)+2H2O![]() CaSO4��2H2O(s)+2 OH��
CaSO4��2H2O(s)+2 OH��
�÷�Ӧ��ƽ�ⳣ������ʽK=_________________________��
��Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ������������ij���������ʣ�����pH=12.3 [��c(OH��)=0.02mol/L]����ʹ��Ӧ�ڳ����������С���Ӧ����ˣ�������Һ��ͨ��CO2����һ�������õ�Na2CO3��
��2����Na2SO4��Ca(OH)2��H2O��Ԫ��ϵ�в�ֱ��ͨ��CO2����������_______________________________________________________________��
��3�����ӵ����������������������д�����㣩��_____________��______________��
��4����ƽ���ƶ�ԭ�����������������ʵ����ɣ�____________________________________����HA��ʾ�����ӵ����ʣ����ܷ�Ӧ�����ӷ���ʽ��дΪ_______________________��
��5��Na2CO3��Һ�д���ˮ��ƽ�⣺CO32����H2O![]() HCO3����OH��������˵���������_________��
HCO3����OH��������˵���������_________��
a����ˮϡ�ͣ���Һ���������ӵ�Ũ�ȶ���С
b��ͨ��CO2����ҺpH��С
c������NaOH���壬![]() ��С
��С
d��ϡ����Һ��ƽ�ⳣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ᾧ������������ʧˮʱ�������������FeSO4��7H2O�������������㣬��ֵ�ᳬ��100�������ұ��涨��FeSO4��7H2O�ĺ�����һ��Ʒ99.50����100.5��������Ʒ99.00����100.5��������Ʒ98.00����101.0����
Ϊ�ⶨ��Ʒ��FeSO4��7H2O�������������ɲ�������������������������Һ���еζ���
5Fe2����MnO4����8H����5Fe3����Mn2����4H2O��
2MnO4����5C2O42����16H����2Mn2����10CO2����8H2O
�ⶨ���̣�����һ��Ũ�ȵĸ��������Һ1L��Ȼ���ȡ0.200 g ����Na2C2O4��ʽ��Ϊ134.0��������ƿ�У�������ˮ�ܽⲢ��ϡ�����ữ��������70�桫80�档
(1)��Ҫ�õζ����ⶨ����ĸ��������ҺŨ�ȣ��ζ��յ��������_______________��
(2)����Һ���ȵ�Ŀ����____����Ӧ�տ�ʼʱ��Ӧ���ʽ�С���������¶�����Ӱ���������Ӱ�컯ѧ��Ӧ���ʵ�������������ԭ�������______________________��
(3)���ζ�ʱ���ֵζ��ܼ��첿�������ݣ��ζ�����������ʧ�����ø������Ũ��_____������ƫ������ƫС������Ӱ��������
(4)�ζ���ȥ���������Һ29.50mL����c(KMnO4)��_____mol/L��������λ��Ч���֣���
(5)��ȡ�ķ�FeSO4��7H2O������������Ϊ0.506g�������������������Һ�ζ��ﵽ�յ㣬��¼�ζ�����
�ζ����� ʵ������ | 1 | 2 | 3 | 4 |
V(�������)/mL(������) | 0.10 | 0.20 | 0.00 | 0.20 |
V(�������)/mL(�ն���) | 17.76 | 17.88 | 18.16 | 17.90 |
��������FeSO4��7H2O�ĺ���������������Ϊ_________��С���������λ�������Ϲ���______������
(6)��ʵ��ȷֵΪ99.80%��ʵ��������=____%��������в����Լ����������յ��жϵ�ʧ�����������Ŀ���ԭ���ǣ�__________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com