
| 阳离子 | K+、NH4+、Fe3+、Ba2+ |
| 阴离子 | Cl-、Br-、CO32-、HCO3-、SO32-、SO42- |
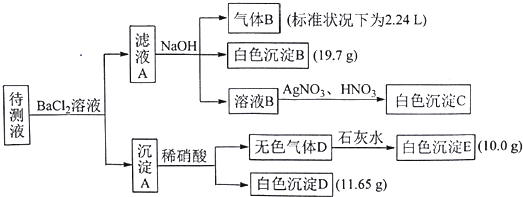
| A. | 向溶液B中加AgNO3与HNO3的操作不是多余的,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-且c(K+)≥0.1mol•L-1 | |
| B. | 生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O | |
| C. | 若无色气体D是单一气体,则原溶液中c(SO42-)=0.05 mol•L-1 | |
| D. | 若无色气体D是混合气体,则沉淀A的成分是BaCO3、BaSO3、BaSO4 |
分析 待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-,据此分析.
解答 解:待测液和氯化钡溶液反应得到沉淀A,则溶液中可能含有CO32-、SO32-、SO42-,向沉淀中加入稀硝酸生成气体,且有部分沉淀不溶解,则溶液中存在CO32-,可能存在SO32-、SO42-中的两种或一种,根据离子共存知,溶液中不存在Ba2+;滤液A中有Ba2+,加入过量的NaOH溶液得到气体B、白色沉淀B,则溶液中一定含有NH4+、HCO3-,一定不存在Fe3+,气体B为NH3,白色沉淀B为BaCO3,滤液B中加入硝酸银、硝酸溶液得到白色沉淀C,C为AgCl,说明滤液B中含有Cl-,由于加入氯化钡溶液,不能确定原溶液中是否含有Cl-,据此分析;
A、向溶液B中加AgNO3与HNO3的操作不是多余的,是为了判断是否含有溴离子,根据上述分析,待测液除含有Na+外,一定含有K+、NH4+、CO32-、HCO3-,n(NH4+)=n(NH3)=$\frac{2.24L}{22.4L/mol}$=0.1mol,则c(NH4+)=0.1mol/L,溶液中c(Na+)=0.2mol/L,c(HCO3-)=0.1mol/L,c(CO32-)=0.1mol/L,c(SO42-)=0.05mol/L,单位体积为正电荷=1×0.1mol/L+1×0.2mol/L=0.3mol/L,单位体积内负电荷=1×0.1mol/L+2×0.1mol/L+2×0.05mol/L=0.4mol/L,则单位体积为正电荷<单位体积内负电荷,故一定含有K+,当溶液中没有Cl-,K+离子浓度最小,根据电荷守恒可知,c(K+)最小浓度=0.4mol/L-0.3mol.L=0.1mol/L,c(K+)≥0.1mol•L-1,故A正确;
B、根据分析生成白色沉淀B的离子方程式为:Ba2++HCO3-+OH-═BaCO3↓+H2O,故B正确;
C、若无色气体D是单一气体,D(硫酸钡)的物质的量=$\frac{11.65g}{233g/mol}$=0.05mol,则n(SO42-)=0.05mol,故c(SO42-)=$\frac{0.05mol}{1L}$=0.05mol/L,故C正确;
D、若无色气体D是混合气体,只能为CO2、NO混合气体,白色沉淀D只能为BaSO4,溶液中一定含有SO32-,不能确定是否含有SO42-,待测液中一定含有的阴离子是CO32-、HCO3-、SO32-,故沉淀A不一定有硫酸钡,故D错误;
故选D.
点评 本题考查了离子的推断、检验,熟悉物质的性质是解本题关键,根据实验过程中反应现象、离子共存条件来确定溶液中存在的离子,注意根据溶液中电荷守恒确定离子是否存在,同时考查学生综合运用知识解决问题的能力,题目难度较大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
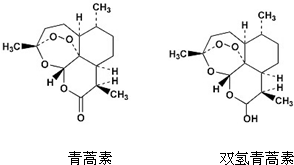 中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )
中国药学家屠呦呦创制出新型抗疟药青蒿素和双氢青蒿素,为此获得2015年诺贝尔生理学或医学奖.青蒿素和双氢青蒿素结构如图所示.下列有关说法正确的是( )| A. | 两种有机物官能团的数目相同 | |
| B. | 两种有机物均可以发生取代反应 | |
| C. | 两种有机物均能和NaOH溶液反应 | |
| D. | 1mol双氢青蒿素与金属钠反应可以得到11.2L的氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
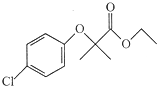 )是临床一种应用广泛的药物,它的一条合成路线如下:
)是临床一种应用广泛的药物,它的一条合成路线如下: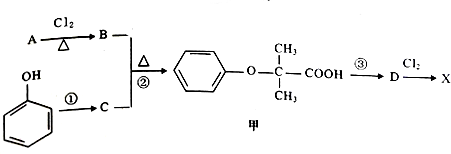
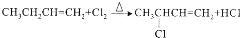
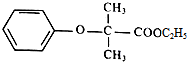 .
. 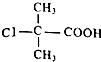 +2NaOH$\stackrel{△}{→}$
+2NaOH$\stackrel{△}{→}$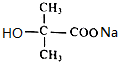 +NaCl+H2O.
+NaCl+H2O. 查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
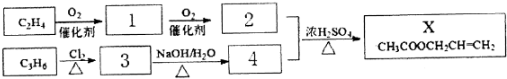
 C.
C.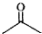 D.
D.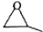
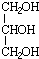 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
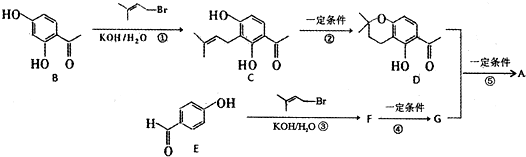
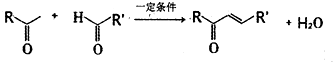
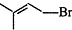 生成高分子化合物的方程式
生成高分子化合物的方程式 .
. 、
、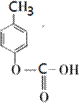 .
.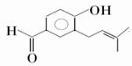 .
.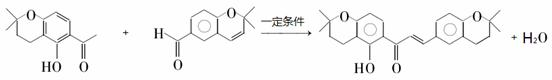 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠长期露置在空气中,最终生成碳酸钠,中间有Na2O2生成 | |
| B. | 比较去锈的铁钉和去锈的绕有细铜丝的铁钉与同浓度盐酸反应速率快慢时,可以加几滴KSCN溶液,观察铁钉周围出现出现血红色现象的快慢 | |
| C. | 原电池的制作:用导线把二极管和锌片、铜片连接起来,锌与铜之间隔一块薄海绵放入稀H2SO4 溶液,二极管发光但很快变暗,若再加入H2O2瞬间又变亮且能持续较长时间 | |
| D. | 在蔗糖中滴加浓硫酸产生的气体,能使酸性KMnO4溶液褪色,说明该气体具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
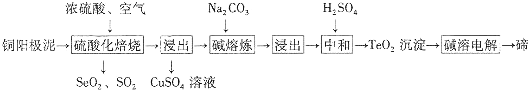
 印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入.硫磺可用于生产化工原料硫酸.某工厂用如图所示的工艺流程生产硫酸:
印尼火山喷发不仅带来壮观的美景,还给附近的居民带来物质财富,有许多居民冒着生命危险在底部的火山口收集纯硫磺块来赚取丰厚收入.硫磺可用于生产化工原料硫酸.某工厂用如图所示的工艺流程生产硫酸:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 石油的蒸馏实验中,加入碎瓷片可防止石油在蒸馏时暴沸 | |
| B. | 乙醇的催化氧化实验中铜丝主要起氧化剂的作用 | |
| C. | 制取乙酸乙酯时,试剂加入的顺序是:先加入乙醇,后慢慢加入乙酸,最后加入浓硫酸 | |
| D. | 在淀粉溶液中加入少量稀硫酸,水浴加热后,再加入少量新制的氢氧化铜悬浊液,加热至沸腾,没有砖红色沉淀生成,说明淀粉没有水解 | |
| E. | 除去甲烷中混有的少量乙烯,可以将混合气体通过酸性溶KMnO4液 | |
| F. | 用钠可以检验某无水酒精中是否含有水 | |
| G. | 可用溴水来鉴别植物油和矿物油 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com