
A、B、C、X均为中学常见的物质,一定条件下它们的转化关系如下(副产物已略去).A 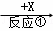 B
B 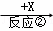 C
C
试回答:
(1)若X为O2,则A不可能是 (填选项).
a.Si b.NH3 c.Mg d.S
(2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,X为CO2,用离子方程式解释B溶液显碱性的原因 ,举出C的一种用途 .
(3)若A是一种黄绿色气体单质,X是一种能使湿润的红色石蕊试纸变蓝的气体,反应①属于置换反应,写出反应①的化学方程式 ,C的水溶液中各离子浓度由大到小顺序为 .
| 无机物的推断.. | |
| 专题: | 推断题. |
| 分析: | (1)若X为O2,A能连续被氧化,则A、B、C中含有的同种元素为变价元素,中学常见N、S元素化合物符合转化关系; (2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,均含有Na元素,X为CO2,由转化关系可知,A为NaOH、B为Na2CO3、C为NaHCO3; (3)若A是一种黄绿色气体单质,则A为Cl2,X是一种能使湿润的红色石蕊试纸变蓝的气体,则X为NH3, 反应①属于置换反应,应是氯气与氨气反应生成氮气与HCl,B能与氨气反应生成C,则B为HCl、C为NH4Cl,NH4Cl溶液中NH4+水解,溶液呈酸性,据此解答. |
| 解答: | 解:(1)若X为O2,A能连续被氧化,则A、B、C中含有的同种元素为变价元素,中学常见N、S元素化合物符合转化关系,Si与氧气反应生成二氧化硅、Mg与氧气反应生成氧化镁,二氧化硅、氧化镁不能与氧气继续反应, 故答案为:ac; (2)若A、B、C的水溶液均显碱性,焰色反应均为黄色,均含有Na元素,X为CO2,由转化关系可知,A为NaOH、B为Na2CO3、C为NaHCO3, Na2CO3溶液中CO32﹣水解:CO32﹣+H2O⇌HCO3﹣+OH﹣,破坏水的电离平衡,溶液呈碱性.碳酸氢钠可以用于制发酵粉、治疗胃酸过多等, 故答案为:CO32﹣+H2O⇌HCO3﹣+OH﹣;制发酵粉或治疗胃酸过多等; (3)若A是一种黄绿色气体单质,则A为Cl2,X是一种能使湿润的红色石蕊试纸变蓝的气体,则X为NH3, 反应①属于置换反应,应是氯气与氨气反应生成氮气与HCl,反应方程式为:3Cl2+2NH3=N2+6HCl,B能与氨气反应生成C,则B为HCl、C为NH4Cl,NH4Cl溶液中NH4+水解:NH4++H2O⇌NH3.H2O+H+,溶液呈酸性,故离子浓度c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣), 故答案为:3Cl2+2NH3=N2+6HCl;c(Cl﹣)>c(NH4+)>c(H+)>c(OH﹣). |
| 点评: | 本题考查无机物推断,涉及N、S、Na、Cl等元素化合物性质与转化,熟练掌握中学常见A |


科目:高中化学 来源: 题型:
如图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是( )
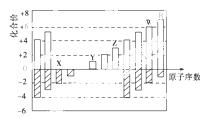
A.原子半径:Z>Y>X
B.气态氢化物的稳定性R>W
C.WX3和水反应形成的化合物是离子化合物
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
由磷灰石[主要成分Ca5(PO4)3F]在高温下制备黄磷(P4)的热化学方程式为:4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)===3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g) ΔH
①上述反应中,副产物矿渣可用来________。
②已知相同条件下:
4Ca5(PO4)3F(s)+3SiO2(s)===6Ca3(PO4)2(s)+2CaSiO3(s)+SiF4(g) ΔH1
2Ca3(PO4)2(s)+10C(s)===P4(g)+6CaO(s)+10CO(g) ΔH2
SiO2(s)+CaO(s)===CaSiO3(s) ΔH3
用ΔH1、ΔH2和ΔH3表示ΔH,ΔH=____________。
(2)(江苏)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜。已知:
①Cu(s)+2H+(aq)===Cu2+(aq)+H2(g)
ΔH1=+64.39 kJ·mol-1
②2H2O2(l)===2H2O(l)+O2(g)
ΔH2=-196.46 kJ·mol-1
③H2(g)+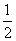 O2(g)===H2O(l)
O2(g)===H2O(l)
ΔH3=-285.84 kJ·mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+和H2O的热化学方程式为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的叙述正确的是( )
|
| A. | 除去水中的Na+、SO42﹣、Cl﹣等杂质可用蒸馏的方法 |
|
| B. | 除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
|
| C. | 用铂丝蘸取少量某溶液进行焰色反应,若火焰呈黄色,则原溶液含有钠盐 |
|
| D. | 某溶液加入盐酸酸化的BaCl2溶液,若有白色沉淀生成,则原溶液含有SO42﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验能达到相应目的是( )
|
| A. |
制备少量的氧气 |
|
| B. |
证明氧化性Cl2>Br2>I2 |
|
| C. |
将海带灼烧成灰 |
|
| D. |
说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式:
(2)H3PO2及NaH2PO2均可将溶液中的银离子还原为银单质,从而可用于化学镀银.
①H3PO2中,磷元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4:1,则氧化产物为: (填化学式)
③NaH2PO2是正盐还是酸式盐?
(3)H3PO2的工业制法是:将白磷(P4)与氢氧化钡溶液反应生成PH3气体和Ba(H2PO2)2,后者再与硫酸反应,写出白磷与氢氧化钡溶液反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1.00 mol·L-1 NaCl溶液中含有Na+的数目为NA
B.常温常压下,6.4 g由氧气和臭氧组成的混合物中含有的分子总数为0.2NA
C.标准状况下,1.12 L HCHO中C原子的数目为0.05 NA
D.一定条件下6.4g SO2与足量氧气反应生成SO3,转移电子数为0.2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com