
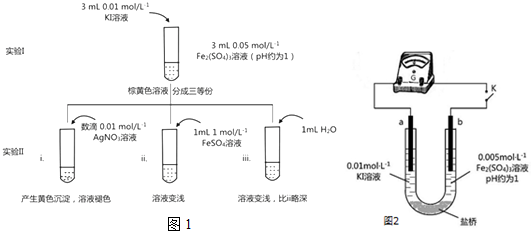
分析 (1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态;
(2)根据实验iii和实验ii的对比可以看出是为了排除有ii中水造成溶液中离子浓度改变的影响;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
ii.加入FeSO4,Fe2+浓度增大,平衡逆移;
①K闭合时,指针向右偏转,可知b极Fe3+得到电子,作正极;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,可知I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
(5)①Fe2+浓度增大,还原性增强;
②与(4)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)将(3)和(4)、(5)作对比,可知氧化性、还原性与浓度有关.
解答 解:(1)待实验I溶液颜色不再改变时,再进行实验II,目的是使实验I的反应达到化学平衡状态,否则干扰平衡移动的判断,
故答案为:化学平衡状态;
(2)由实验iii和实验ii的对比可知,对比实验的目的是为了排除有ii中水造成溶液中离子浓度改变的影响,
故答案为:溶液稀释对颜色的变化;
(3)i.加入AgNO3,Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动,可知Fe2+向Fe3+转化,
故答案为:Ag+与I-生成AgI黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动;
ii.加入FeSO4,Fe2+浓度增大,平衡逆移;
①K闭合时,指针向右偏转,右侧为正极,可知b极Fe3+得到电子,则b作正极,
故答案为:正;
②当指针归零(反应达到平衡)后,向U型管左管中滴加0.01mol/L AgNO3溶液,若生成黄色沉淀,I-浓度降低,2Fe3++2I-?2Fe2++I2平衡逆向移动,指针向左偏转,也可证明推测Fe2+向Fe3+转化,
故答案为:左管出现黄色沉淀,指针向左偏转;
(5)①转化的原因为Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-,
故答案为:Fe2+浓度增大,还原性增强,使Fe2+还原性强于I-;
②与(4)实验对比,不同的操作是当指针归零(反应达到平衡)后,向U型管右管中滴加0.01mol/L FeSO4溶液,Fe2+向Fe3+转化,
故答案为:向U型管右管中滴加0.01mol/L FeSO4溶液;
(6)将(3)和(4)、(5)作对比,得出的结论是该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动,
故答案为:该反应为可逆的氧化还原反应,在平衡时,通过改变物质的浓度,可以改变物质的氧化、还原能力,并影响平衡移动.
点评 本题为2015年北京高考真题,侧重原电池、氧化还原反应及平衡移动的综合考查,把握平衡移动的影响因素及物质的性质为解答的关键,对分析与实验能力要求较高,题目难度较大.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
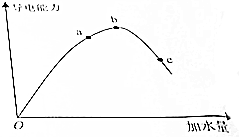 在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如图所示,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子中共价键比氯化钠中离子键弱 | |
| B. | 水的相对分子质量比氯化钠的小 | |
| C. | 水分子间有范德华力,氯化钠分子间的作用力较强 | |
| D. | 水分子间是以范德华力相结合,相互作用较弱;氯化钠晶体中,Na+和Cl-以离子键相结合,作用力较强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO${\;}_{3}^{-}$═Fe3++NO↑+2H2O | |
| B. | 向NH4HSO4溶液中逐滴滴入Ba(OH)2溶液至恰好沉淀完全2OH-+Ba2++2H++SO${\;}_{4}^{2-}$═2H2O+BaSO4↓ | |
| C. | 向亚硫酸钡固体中加入稀硝酸:3BaSO3+2H++2NO${\;}_{3}^{-}$═3BaSO4↓+2NO↑+H2O | |
| D. | 向Ca(ClO)2溶液中通入足量CO2:Ca2++CO2+H2O═CaCO3↓+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、SO${\;}_{3}^{2-}$、SO${\;}_{4}^{2-}$、K+ | B. | Na+、Cu2+、Br-、Ba2+ | ||
| C. | K+、MnO${\;}_{4}^{-}$、NO${\;}_{3}^{-}$、Na+ | D. | K+、Ca2+、SO${\;}_{3}^{2-}$、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
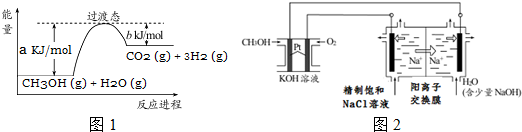
 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com