
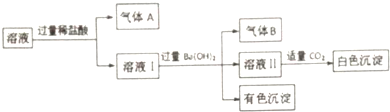
| A. | 气体A一定没有CO2,气体B一定是NH3 | |
| B. | 有色沉淀一定是混合物 | |
| C. | Na+可能存在于该溶液中 | |
| D. | 白色沉淀中一定没有Al(OH)3 |
分析 溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,存在的各离子具有相同的物质的量,则存在NO3-、SO42-,溶液Ⅱ呈碱性,白色沉淀碳酸钡,以此解答该题.
解答 解:溶液加入盐酸生成气体,可能含有CO32-,或为Fe2+、NO3-发生氧化还原反应生成NO,溶液Ⅰ加入过量氢氧化钡生成气体B,一定为氨气,则存在NH4+,有色沉淀为氢氧化铁,则含有Fe2+,可知不存在CO32-,存在的各离子具有相同的物质的量,则存在NO3-、SO42-,溶液Ⅱ呈碱性,白色沉淀碳酸钡,
A.由以上分析可知A为NO,没有CO2,故A正确;
B.有色沉淀为氢氧化铁,故B错误;
C.题中存在的各离子具有相同的物质的量,含有Fe2+、NH4+、NO3-、SO42-,不含Na+,故C错误;
D.不含Al3+,则白色沉淀中一定没有Al(OH)3,故D正确.
故选BC.
点评 本题考查了离子共存、常见离子的检验方法,题目难度中等,注意掌握常见离子的性质及检验方法,要求学生能够根据反应现象判断离子存在情况,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:解答题
 ,元素Z在周期表中的位置是第三周期ⅣA族.
,元素Z在周期表中的位置是第三周期ⅣA族.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于盐酸:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 淀粉碘化钾溶液在空气中变蓝:4I-+O2+2H2O=2I2+4OH- | |
| C. | Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ | |
| D. | 氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
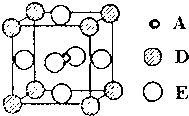 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{12n}{m}$ | B. | $\frac{m}{12n}$ | C. | $\frac{12m}{n}$ | D. | $\frac{m}{n}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯与氯气加成(1,2-二氯乙烷) | |
| B. | 1,3-丁二烯与足量氢气加成(丁烷) | |
| C. | 氯气与苯用氯化铁作催化剂反应(氯苯) | |
| D. | 等物质的量的氯气与乙烷在光照条件下反应(氯乙烷) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该合金中铁的质量为5.6g | |
| B. | 合金与稀硫酸反应共生成0.45mol H2 | |
| C. | 该合金与足量氢氧化钠反应,转移的电子数为0.6NA | |
| D. | 所加的稀硫酸中含0.6molH2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:
绿矾(FeSO4•7H2O)和胆矾(CuSO4•5H2O)都是重要的化工原料.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com