
【题目】下列关于硅与氢氧化钠溶液反应(Si+2NaOH+H2O=Na2SiO3+2H2↑)的说法正确的是( )
A.氧化剂是NaOH和H2OB.氧化剂是H2O
C.氧化剂是SiD.还原剂是H2O
科目:高中化学 来源: 题型:
【题目】某铜矿石的主要成分是Cu2O,还含有少量的Al2O3、Fe2O3和SiO2。某工厂利用此矿石炼制精铜的工艺流程如图所示(已知:Cu2O+2H+===Cu+Cu2++H2O)。

(1)滤液A中铁元素的存在形式为______________(填离子符号),生成该离子的离子方程式为_______________,检验滤液A中存在该离子的试剂为___________(填试剂名称)。
(2)金属E与固体F发生的某一反应可用于焊接钢轨,该反应的化学方程式为_________________________,在实验室中完成此实验还需要的试剂是________。
a.KClO3 b.KCl c.Mg d.MnO2
(3)为使固体混合物D在空气中灼烧完全分解,应_____________,直至连续两次测定的实验结果相同(或质量相差小于0.1 g)时为止;灼烧时必须用到的实验仪器是__________。
(4)溶液G与固体混合物B反应的离子方程式为__________________________。
(5)将Na2CO3溶液滴入到一定量的CuCl2溶液中,得到氯化钠、二氧化碳和一种绿色的不溶于水的盐(不含结晶水),该盐受热分解产生三种氧化物,则该盐的化学式是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(Ⅰ)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知A和B原子具有相同的电子层数,且A元素的最高正价与最低负价和为零,C是同周期中原子半径最大的元素,D是同周期中离子半径最小的元素。C的单质在加热条件下与B的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物F。试根据以上叙述回答:
(1)D元素在周期表中位置为_____________________;
(2)画出E的离子结构示意图_____________;写出ABE分子的结构式____________;
(3)工业上常用在微波条件下用A单质与EB2反应来解决其产生的环境问题,写出该化学方程式:___________________________________________;
(4)用电子式表示C2E的形成过程__________________________________________;
(5)1 mol C与A元素的最高价氧化物反应时转移的电子数为_________。
(Ⅱ)、某化学兴趣小组为研究生铁(含碳)与浓硫酸的反应情况及产物性质,设计如下实验。请回答下列问题:
(1)按右图所示装置进行实验(夹持装置及尾气处理装置未画出)。仪器b的名称是_________;实验过程中,装置B中观察的现象是___________;装置C中有白色沉淀生成,该沉淀是__________(填化学式)。

(2)装置A反应容器中还会产生CO2气体,请写出产生CO2的化学方程式__________。
(3)为了验证装置A中产生的气体中含有CO2,应先从下列①~④中选出必要的装置连接A装置中c处管口,从左到右的顺序为__________(填序号);然后再进行的操作是从a处多次鼓入N2,其目的是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A. CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
O2(g)===CO2(g)+2H2O(l);ΔH=" +725.8" kJ/mol
B. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -1452 kJ/mol
C. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH= -725.8 kJ/mol
D. 2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l);ΔH=" +1452" kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molHClO中所含H—Cl键的数目为NA
B. 8.8g乙酸乙酯中所含碳原子数为0.4NA
C. 1.2gC与0.1molCO2在高温下充分反应生成的CO分子数为0.1NA
D. 标准状况下,1L0.1mol·L-1HCl溶液中滴加氨水至pH=7,溶液中![]() 的数目为0.1NA
的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应Fe(s) +CO2 (g)![]() FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15。下列说法正确的是
A. 升高温度该反应的正反应速率增大,逆反应速率减小
B. 该反应的化学平衡常数表达式为K=![]()
C. 绝热容器中进行该反应,温度不再变化,则达到化学平衡状态
D. 该反应的正反应是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度为T时,向2.0 L恒容密闭容器中充入1.0 molA和1.0 molB,发生反应A(g)+B(g)![]() C(g),一段时间后达到平衡。测定得部分数据见下表:
C(g),一段时间后达到平衡。测定得部分数据见下表:
t/s | 0 | 5 | 15 | 25 | 35 |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
(1)反应前5 s的平均反应速率v(A)=____________。
(2)温度为T时,达到平衡后B物质的量的浓度=________。
(3)升高温度,平衡时c(A)=0.41 mol·L-1,则反应的ΔH_______0(填“>”或“<”)。
(4)下列措施能增大反应速率,且平衡向正反应方向移动是__________。
a.及时分离出A气体 b.适当升高温度 c.增大B的浓度 d.选择高效催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌溴液流电池是一种新型电化学储能装置(如下图所示),电解液为溴化锌水溶液,电解液在电解质储罐和电池间不断循环。下列说法正确的是( )
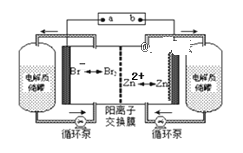
A. 充电时阴极的电极反应式为:Br2+2e-=2Br-
B. 放电时每转移2mol电子,负极区质量减少65克
C. 放电时左侧电解质储罐中的离子总浓度增大
D. 充电是b接电源的正极,Zn2+通过阳离子交换膜由左侧流向右侧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com