
分析 (1)亚铁离子具有还原性,能被氧化剂氧化为铁离子,铁离子遇到硫氰化钾显示红色;
(2)亚铁离子不稳定,易被氧化为铁离子,根据化合价升降判断电子转移情况;
(3)净化发黄的深井水,以作生活用水,可以向水中加入可以将铁离子沉淀的物质,但是不能加入对人体有害的物质;
(4)在发黄的Fe3+的溶液中,加入H2O2,会发生反应生成亚铁离子和水,双氧水是还原剂,据此回答.
解答 解:(1)亚铁离子具有还原性,能被氧化剂氧化为铁离子,铁离子遇到硫氰化钾显示红色,检验的方法为:取少量井水,滴加KSCN溶液无变化,再加氯水,溶液变为血红色则有Fe2+,
故答案为:取少量井水,滴加KSCN溶液无变化,再加氯水,溶液变为血红色则有Fe2+.
(2)亚铁离子不稳定,易被氧化为铁离子,反应为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓,当有12mol电子转移时,则有4mol沉淀生成,当0.12mol电子转移时,则有0.04mol沉淀生成,故答案为:12Fe2++3O2+6H2O=8Fe3++4Fe(OH)3↓;0.04;
(3)为了净化发黄的深井水,以作生活用水,可以向水中加入可以将铁离子沉淀的物质,但是不能加入对人体有害的物质,所以氢氧化钠、铜不可选,故选bd;
(4)在发黄的Fe3+的溶液中,加入H2O2,会发生反应生成亚铁离子和水,双氧水是还原剂,氧化产物是氧气,H2O2-2e→O2↑+2H+,故答案为:O2↑+2H+.
点评 本题考查学生物质的性质以及离子的检验等知识,注意知识的迁移应用是关键,难度不大.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | -2 |
| A. | L2+与R2-的核外电子数相等 | B. | M与T形成的化合物具有两性 | ||
| C. | 气态氢化物的稳定性为H2T>H2R | D. | L和M金属性强弱比较:L>M |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为减缓金属腐蚀,可将要保护的金属物件与外电源的正极相连接做阴极 | |
| B. | 在pH<5的溶液中,金属主要发生析氢腐蚀 | |
| C. | 钢铁制品吸氧腐蚀时正极反应为:O2+2H2O+4e-=4OH- | |
| D. | 在金属物件表面涂上机油可防止金属生锈从而使金属保持光泽 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;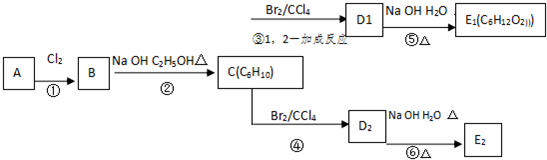
 ;C的化学名称为2,3-二甲基-1,3-丁二烯; ④、⑥的反应类型依次是1,4-加成反应、取代反应.
;C的化学名称为2,3-二甲基-1,3-丁二烯; ④、⑥的反应类型依次是1,4-加成反应、取代反应.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用湿润的蓝色石蕊试纸检验Cl2中的HCl | |
| B. | 可以用湿润的有色布条检验Cl2中的HCl | |
| C. | 可以用饱和NaCl溶液除去Cl2中的HCl | |
| D. | 可以用饱和NaOH溶液除去Cl2中的HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com